
TEORÍA
0.1. GENERALIDADES DE TUMORES DE PARTES BLANDAS
Autores
1. Ramos Pascua, Luis Rafaela
2. Arroyo Hernández, Martaa
3. Peiró Ibañez, Anab
4. Machado Granados, Paub
Especialidad
Cirugía Ortopédica y Traumatología
Centro
aHospital Universitario 12 de Octubre, Madrid
bHospital de Sant Pau, Barcelona
1. DEFINICIÓN
Los tumores de partes blandas (TPB) son neoplasias del mesénquima extraesquelético, con exclusión de la glía, el sistema reticuloendotelial y los tejidos de sostén de órganos y vísceras, que derivan del mesodermo embrionario.
2. CLASIFICACIÓN
Por su comportamiento biológico los TPB se clasifican en benignos y malignos. Estos últimos incluyen los sarcomas de partes blandas (SPB), con más de 100 subtipos histológicos diferentes, y las metástasis. La clasificación histológica es muy extensa y está en permanente revisión1,2. En la del año 2020 de la OMS se describen nuevos tumores (tumor lipomatoso pleomórfico/atípico de células fusiformes, angiofibroma de partes blandas y sarcoma CIC-reordenado); cambios pronósticos en varias entidades (liposarcoma desdiferenciado y tumor fibroso solitario); y muchas alteraciones genéticas, algunas de interés diagnóstico (NAB2-STAT6 en el tumor fibroso solitario, reordenamientos FOSB en hemangiomas epitelioides y hemangioendotelioma pseudomiogénico y mutaciones SUZ12 o EED en tumores malignos de vaina nerviosa periférica, lo cual conduce a la pérdida de la trimetilación de H3K27)5.
3. DEMOGRAFÍA
3.1. Incidencia: Los tumores de partes blandas benignos son, al menos, 100-150 veces más frecuentes que los malignos. Su incidencia anual, si bien seguramente infraestimada, se estima en 300 casos/100.000 habitantes. Los tumores más frecuentes son el lipoma y el fibroma, seguidos de fascitis nodulares, angiomas, tumores neurogénicos y desmoides. El hemangioma es el tumor benigno más común en la infancia, presentándose en el 1-2,6% de los neonatos y en el 10-12% de los niños de un año.
La incidencia de SPB, por su parte, se calcula en 2-4 casos por 100.000 habitantes y año, suponiendo 3 veces más que la de los sarcomas óseos y algo menos del 1% de todos los cánceres (6-9). Los más frecuentes son los sarcomas pleomórficos indiferenciados (24-36%) y los liposarcomas (14-17%), que suelen diagnosticarse por encima y por debajo, respectivamente, de 50 años (Figura 1). Le suelen seguir los sarcomas sinoviales (5-17%), los rabdomiosarcomas (13%), los leiomiosarcomas (4-12%) y los neurofibrosarcomas (6%)1,3-5. Un 12-18% serían sarcomas no clasificados (11,12). En la edad infantil los SPB suponen el 20% de todos los tumores pediátricos sólidos.
Figura 1:
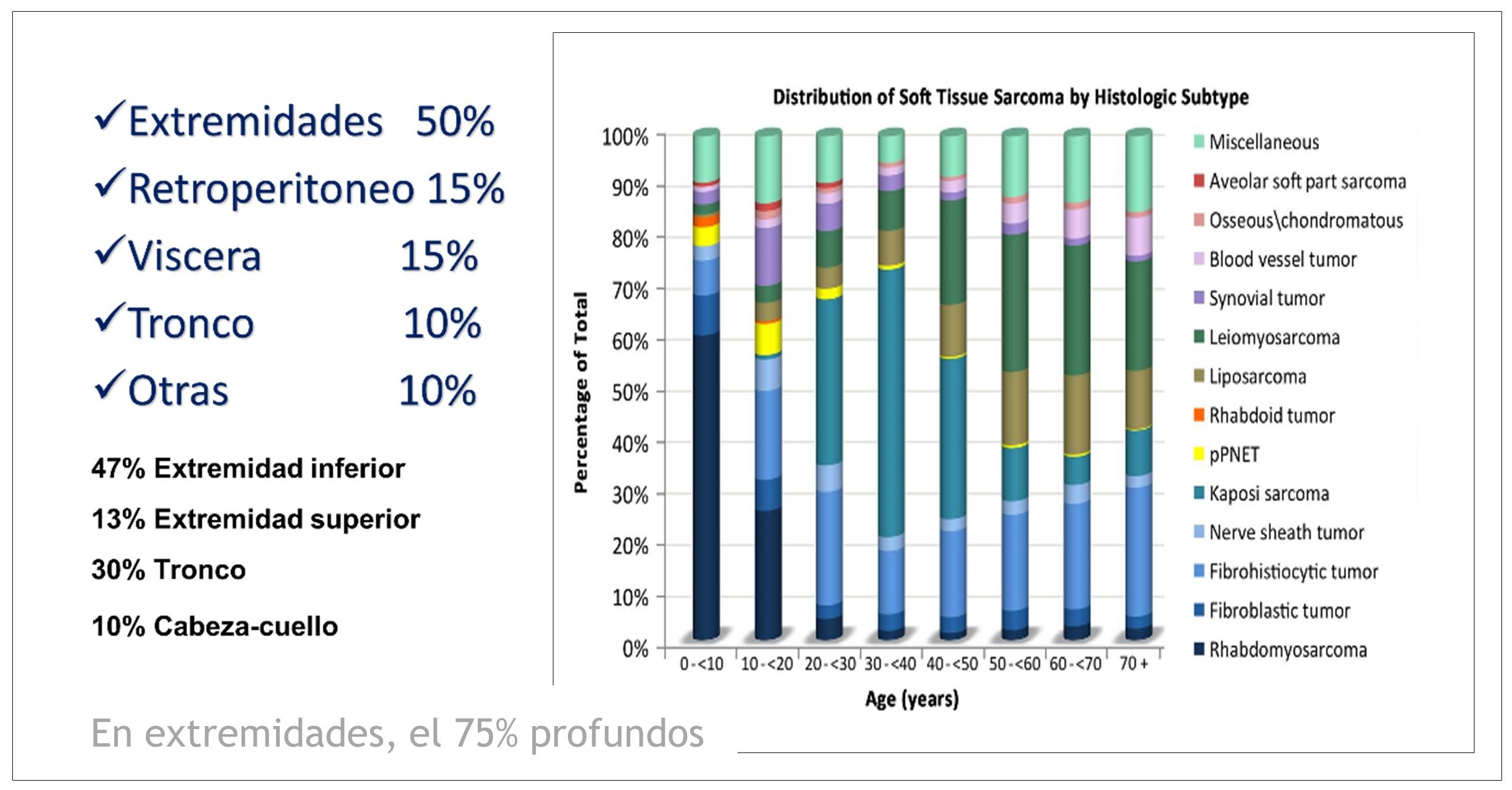
3.2. Sexo y edad: Los SPB son levemente más frecuentes en hombres que en mujeres, salvo los sarcomas de células claras; y la mayoría se diagnostican en mayores de 40 años. De forma particular, los rabdomiosarcomas son propios de niños; el sarcoma sinovial, de varones adultos jóvenes; y el sarcoma epitelioide, de jóvenes de 6-25 años.
3.3. Localización: El 60% los SPB asientan en las extremidades, sobre todo en las inferiores y la nalga (45%) (Figura 1). El resto se localiza en el tronco (19%), el retroperitoneo (15%) o la cabeza y el cuello (5-9%)2. Aproximadamente el 20% son superficiales6. El sarcoma epitelioide tiene preferencia por la mano. En el pie la mayoría de las lesiones de partes blandas son reactivas o de naturaleza inflamatoria.
Figura 1:

4. ETIOPATOGENIA
Los SPB derivan de los tejidos mesenquimales, caracterizados porque sus células no suelen dividirse en la vida adulta. Por una causa que habitualmente se desconoce las células tumorales crecen de forma centrípeta y descontrolada extendiéndose localmente. Cuando contactan con estructuras vasculares se propagarían a órganos a distancia, haciéndolo al pulmón por vía hematógena o, menos veces, a ganglios linfáticos. Estas metástasis son más frecuentes en los angiosarcomas, sarcomas epitelioides, rabdomiosarcomas, sarcomas de células claras y sarcoma sinovial.
5. PRESENTACIÓN CLÍNICA
La sintomatología de un tumor de partes blandas es inespecífica (Figura 2). El signo fundamental es la tumoración, que a menudo se descubre de forma casual. Cuando tiene más de 5 cm de tamaño, es profunda a la fascia, no necesariamente dolorosa y crece
o reaparece después de resecada hay que sospechar malignidad. No obstante, también hay sarcomas de partes blandas superficiales y de pequeño tamaño.
Figura 2:
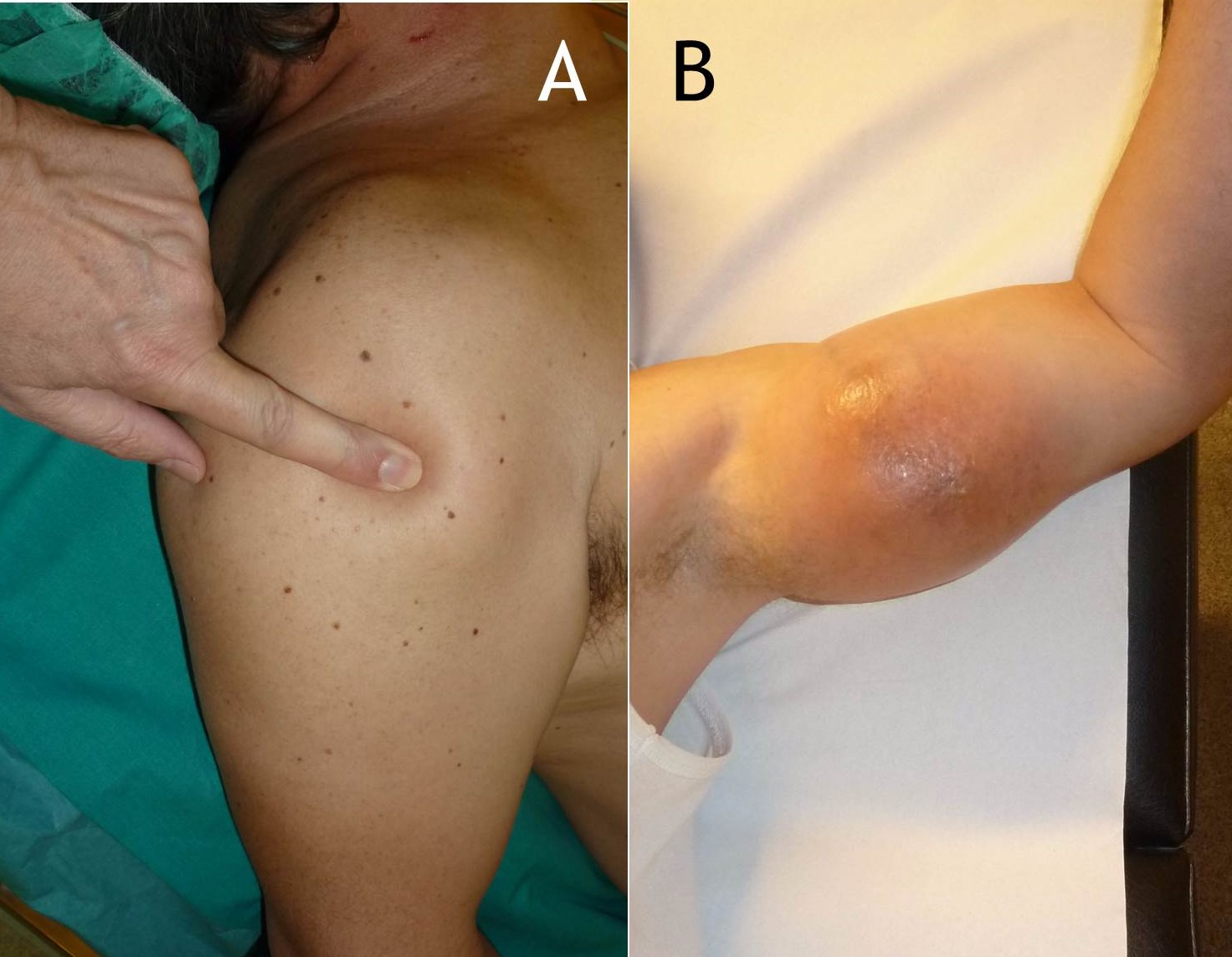
Dependiendo de su tamaño y localización, un tumor de partes blandas puede presentar otros síntomas y signos, generalmente por compresión de estructuras vecinas. Cuando se trata de un sarcoma y la enfermedad es metastásica puede añadirse la semiología constitucional correspondiente.
Como hallazgos específicos de valor diagnóstico3, sugiriendo lesiones benignas, las equimosis superficiales suelen ser propias de hematomas traumáticos, aunque pueden confundirse con SPB cuando no se explican por otro motivo; los signos flogóticos y la fluctuación sugieren una infección; las hernias musculares se modifican con el ejercicio; los gangliones se pueden transiluminar con una linterna; las lesiones vasculares (hemangiomas y malformaciones arteriovenosas) pueden tener soplos o thrills palpables; y los tumores de vainas nerviosas periféricas pueden cursar con un signo de Tinel positivo o dolor a la compresión3.
6. PRUEBAS DE LABORATORIO
Sin interés.
7. PRUEBAS DE IMAGEN
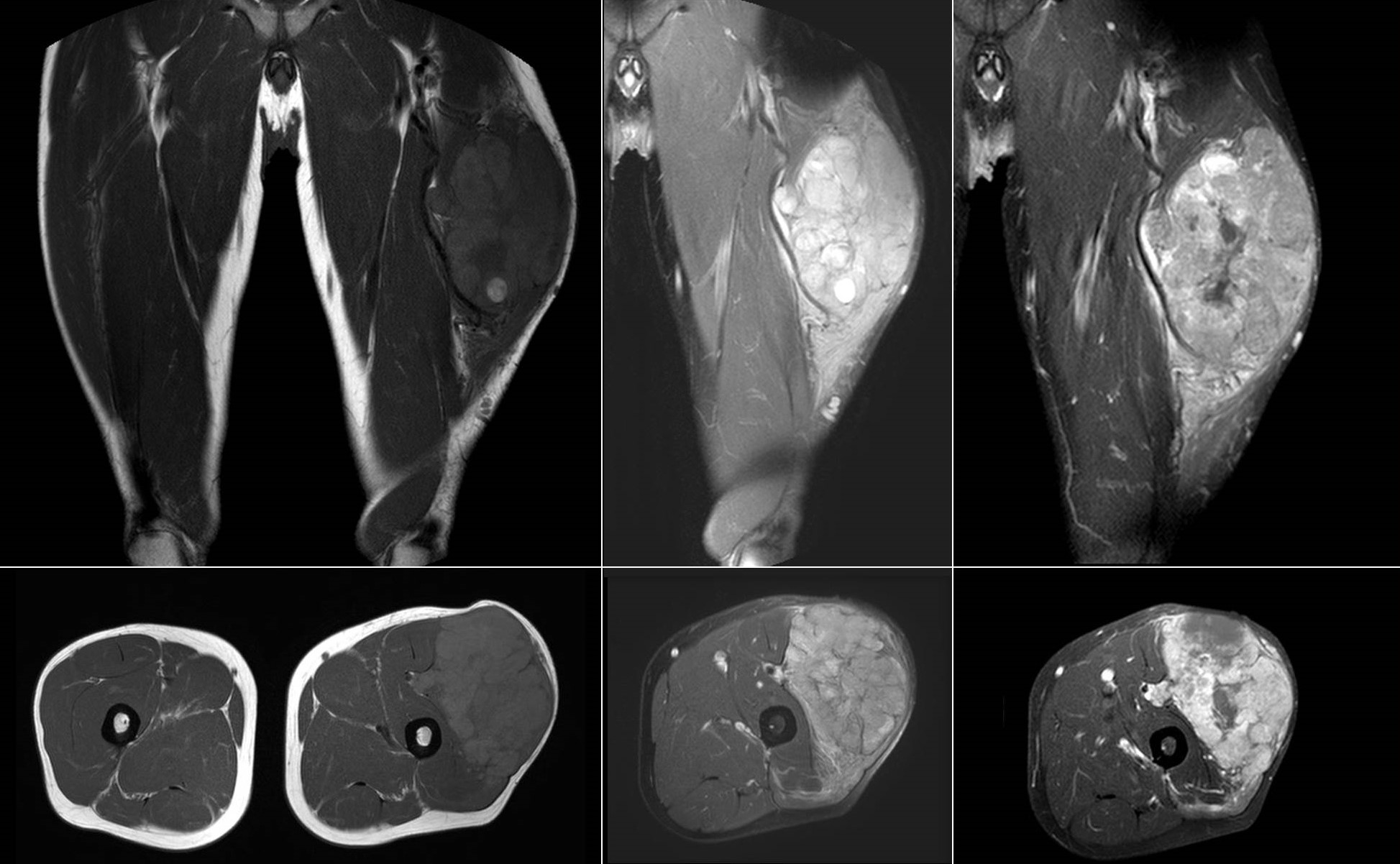
En todos los casos habría que realizar una radiografía simple como primera prueba complementaria de imagen. Después, una ecografía y/o una RM (Figura 3), pudiendo ser útil otras como la TC para caracterizar algún caso particular. A nivel sistémico, cuando
se requiera, está indicado el estudio correspondiente. En los capítulos específicos de este curso sobre el tema se completa este apartado.
Figura 3:
8. ANATOMÍA PATOLÓGICA
El estudio anatomo-patológico de un tumor de partes blandas incluye un estudio morfológico y, en algunos casos, estudios inmunohistoquímico y molecular3,7. El estudio morfológico intenta determinar el tipo histológico del tumor, el subtipo y el grado de malignidad. Los estudios de inmunohistoquímica permiten determinar el tipo de diferenciación tumoral (muscular, neural, etc) y descartar otros tumores no mesenquimales (carcinoma, melanoma o linfoma), pero no informan sobre la benignidad o malignidad lesional. El estudio molecular pretende identificar anomalías cromosómicas y sus fusiones génicas mediante la reacción en cadena de la polimerasa (PCR) o la técnica de la hibridación in situ fluorescente (FISH). Está indicado particularmente ante variantes morfológicas poco habituales, como puede ser un sarcoma sinovial con morfología de células redondas; en sarcomas de edad y/o localización anómala; para la detección de mutaciones puntuales en genes clave para la señalización celular; y cuando pueda tener relevancia pronóstica-predictiva.
Los SPB presentan una amplia variedad de subtipos histológicos y su grado histopatológico está correlacionado con el pronóstico de la enfermedad. También determina el tipo de cirugía y los tratamientos adyuvantes.
9. DIAGNÓSTICO Y DIAGNÓSTICO DIFERENCIAL
9.2 . Diagnóstico de sospecha
La sospecha de un tumor de partes blandas es clínica y comienza con una historia clínica completa. En la anamnesis hay que incluir los antecedentes personales y familiares del paciente; y en la exploración física, además de la exploración local, la regional para identificar adenopatías y una exploración general. Las pruebas complementarias de imagen deben incluir una radiografía y una ecografía y/o RM en todos los pacientes8,9. Después, en función de cada caso, se completará con otras pruebas locales o que investiguen la posible extensión de la enfermedad.
9.3. Diagnóstico de confirmación
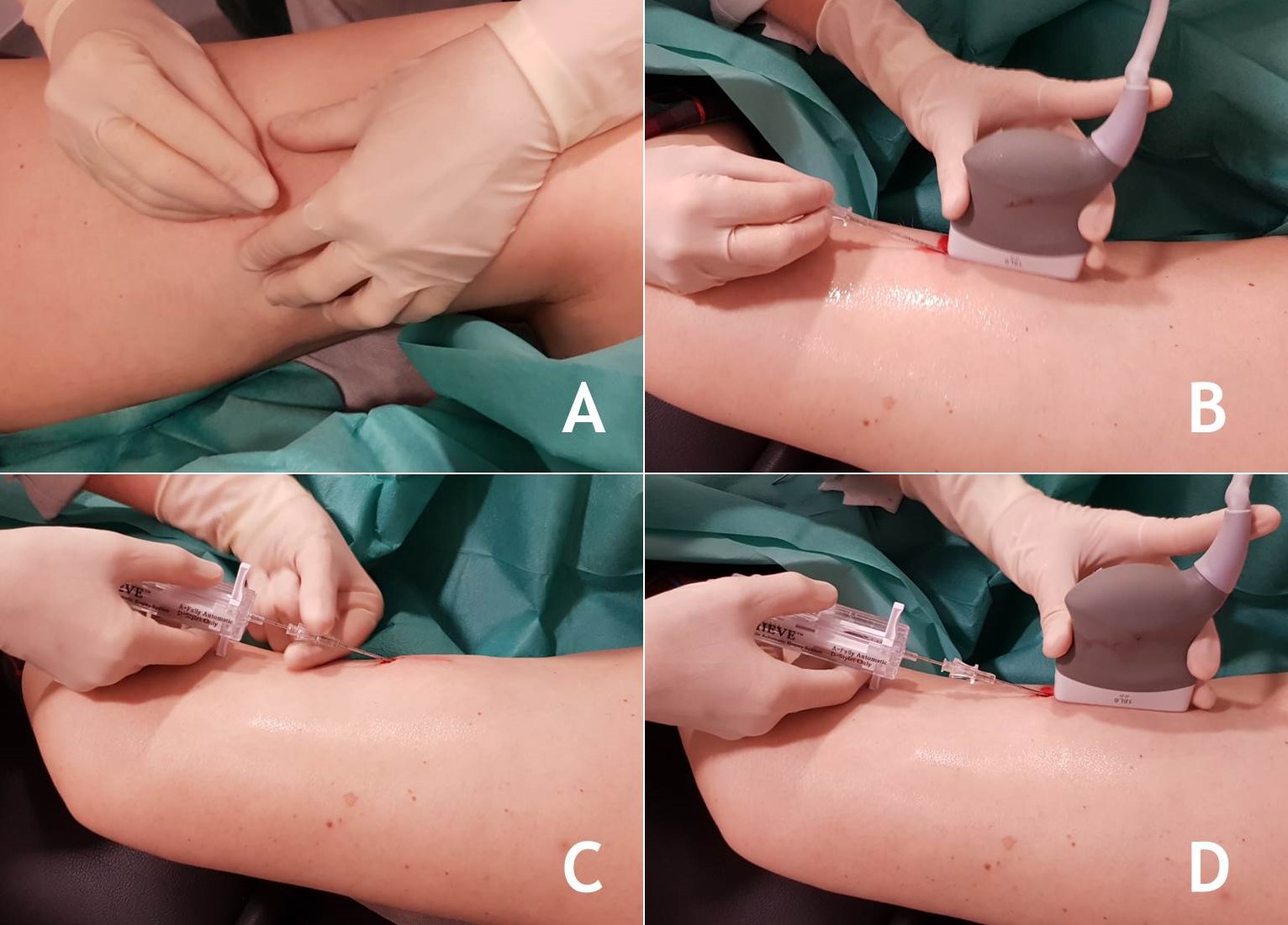
La confirmación de un TPB es anatomo-patológica a partir de la muestra que proporciona una biopsia tomada de zonas de tejido tumoral viable (o no necrótico)8. Esta suele ser cerrada con aguja gruesa y guiada por imágenes (Figura 4), aunque otros tipos de biopsia son posibles, como veremos en el capítulo correspondiente. De cualquier forma, los hallazgos patológicos siempre deben confrontarse con los clínicos y con los de imagen, máxime teniendo en cuenta la compleja clasificación actual de los sarcomas4,10.
Figura 4:
9.4. Estadificación
La estadificación de un SPB precisa de otras pruebas complementarias de imagen. En todos los casos está indicada una TC torácica, que podría sustituirse por una radiografía simple de tórax en el paciente anciano y en aquéllos con lesiones pequeñas de bajo grado. La TC abdomino-pélvica, la gammagrafía ósea y la PET no se recomiendan como pruebas de rutina, aunque sí en algunos tipos histológicos y en casos particulares. Así, por ejemplo, la TC abdomino-pélvica está indicada en sarcomas retroperitoneales, en liposarcomas mixoides (en los que son frecuentes las lesiones sincrónicas) y en SPB en los que las metástasis ganglionares son más frecuentes3. La PET, cuyo papel no está perfectamente definido, puede combinarse con la TC y la RM. Finalmente, en los liposarcomas mixoides, dada su tendencia a las metástasis extrapulmonares, se podría realizar una RM de toda la columna. Con todo, los sistemas que se siguen empleando en la actualidad son los de la MSTS y el de la AJCC1,5.
Los cambios mayores de la octava edición de la AJCC referidos a los SPB incluyen la consideración de cuatro localizaciones tumorales: tronco y extremidades, retroperitoneo, cabeza y cuello y vísceras; y que cualquier tumor TN1M0 del tronco y las extremidades se considera estadio IV mientras que en los retroperitoneales, el mismo tumor sigue considerándose en estadio IIIB. En relación con el tamaño, en el tronco, extremidades y retroperitoneo se distinguen 4 categorías: ≤ 5 cm (a), > 5 cm y ≤ 10 cm (b), > 10 cm y ≤ 15 cm (c) y > 15 cm (d). Finalmente, la anotación de profundo o superficial a la fascia se ha eliminado1.
9.5. Diagnóstico diferencial
El diagnóstico diferencial de los TPB es muy amplio. De entrada, lo fundamental es distinguir las formas benignas de las malignas. A partir de ahí se podrían confundir con lesiones reactivas, infecciones, enfermedades metabólicas y de depósito, etc (Figuras 5-10). En los casos de malignidad hay que diferenciar los sarcomas de los linfomas y los carcinomas.
Figura 5:
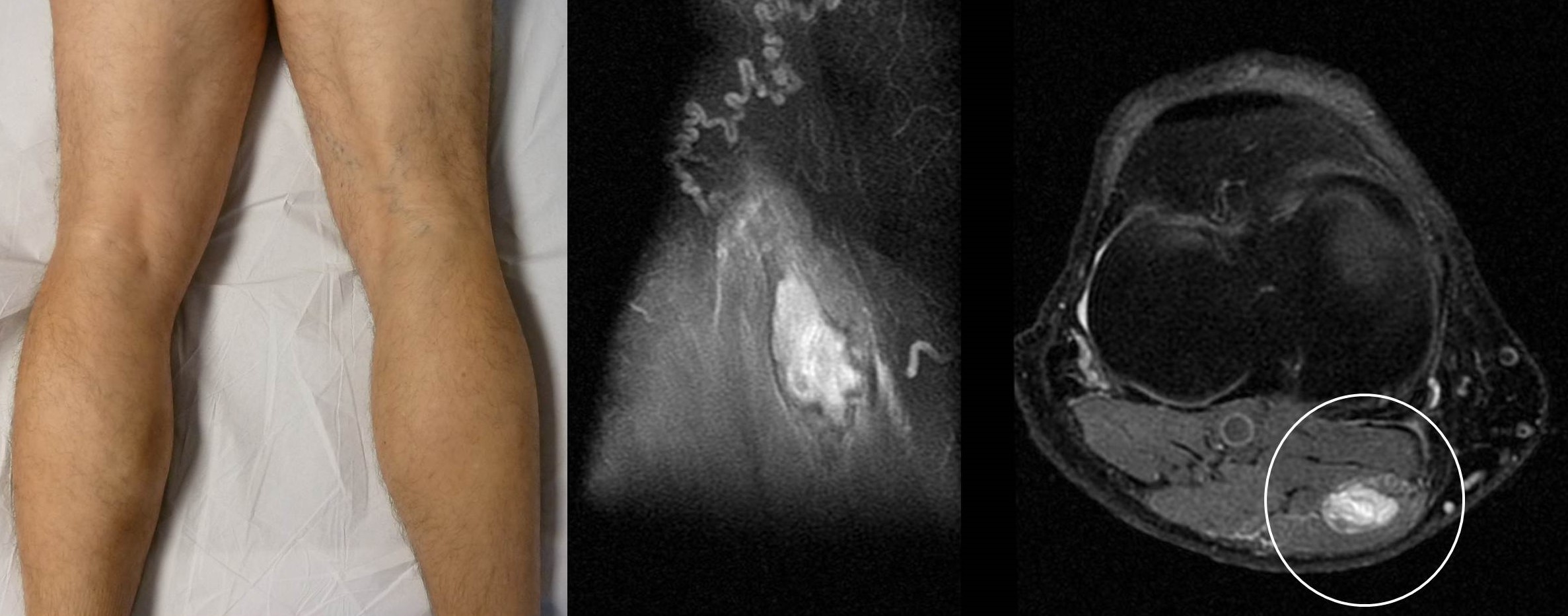
Figura 6:

Figura 7:
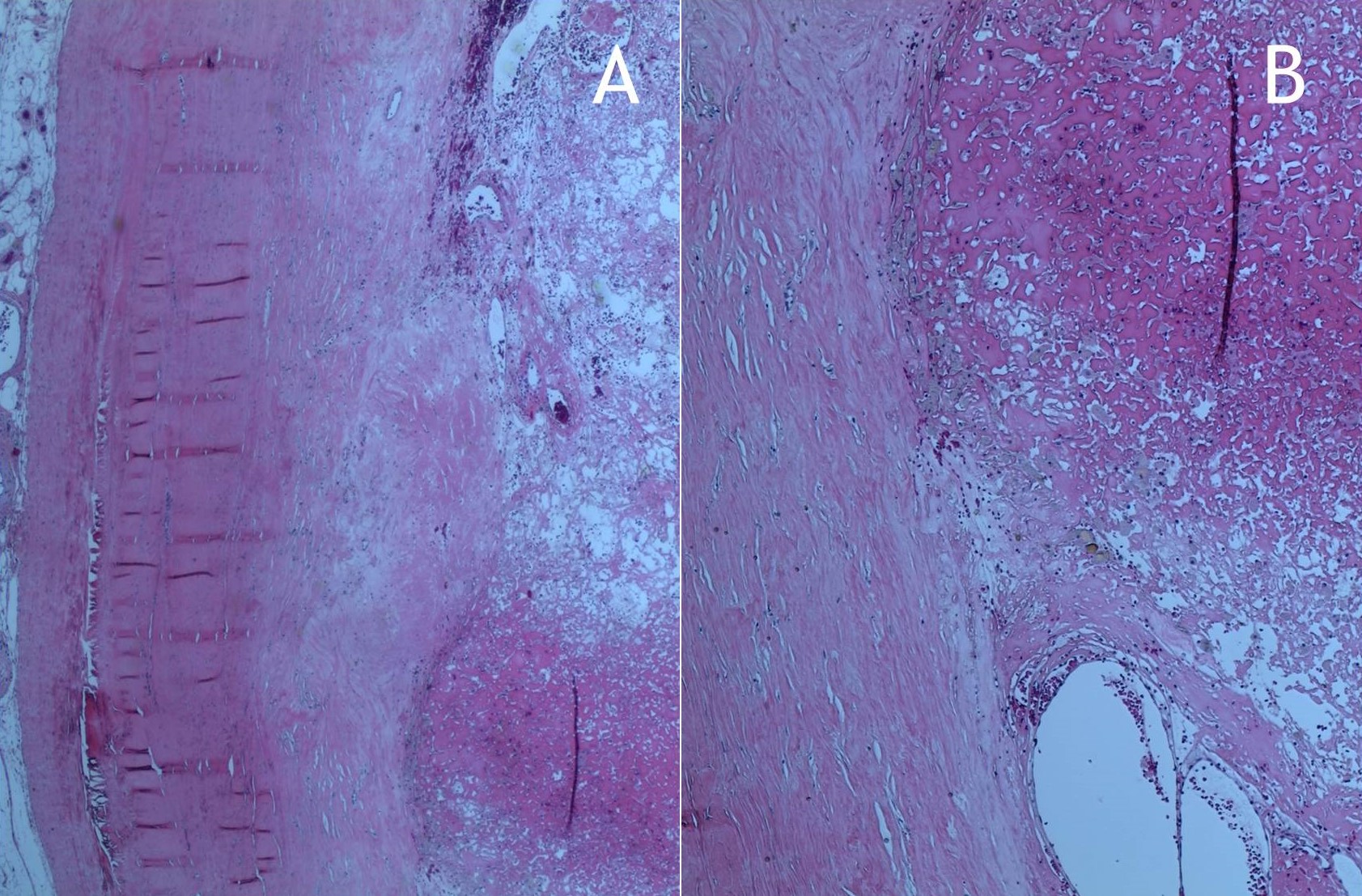
Figura 8:
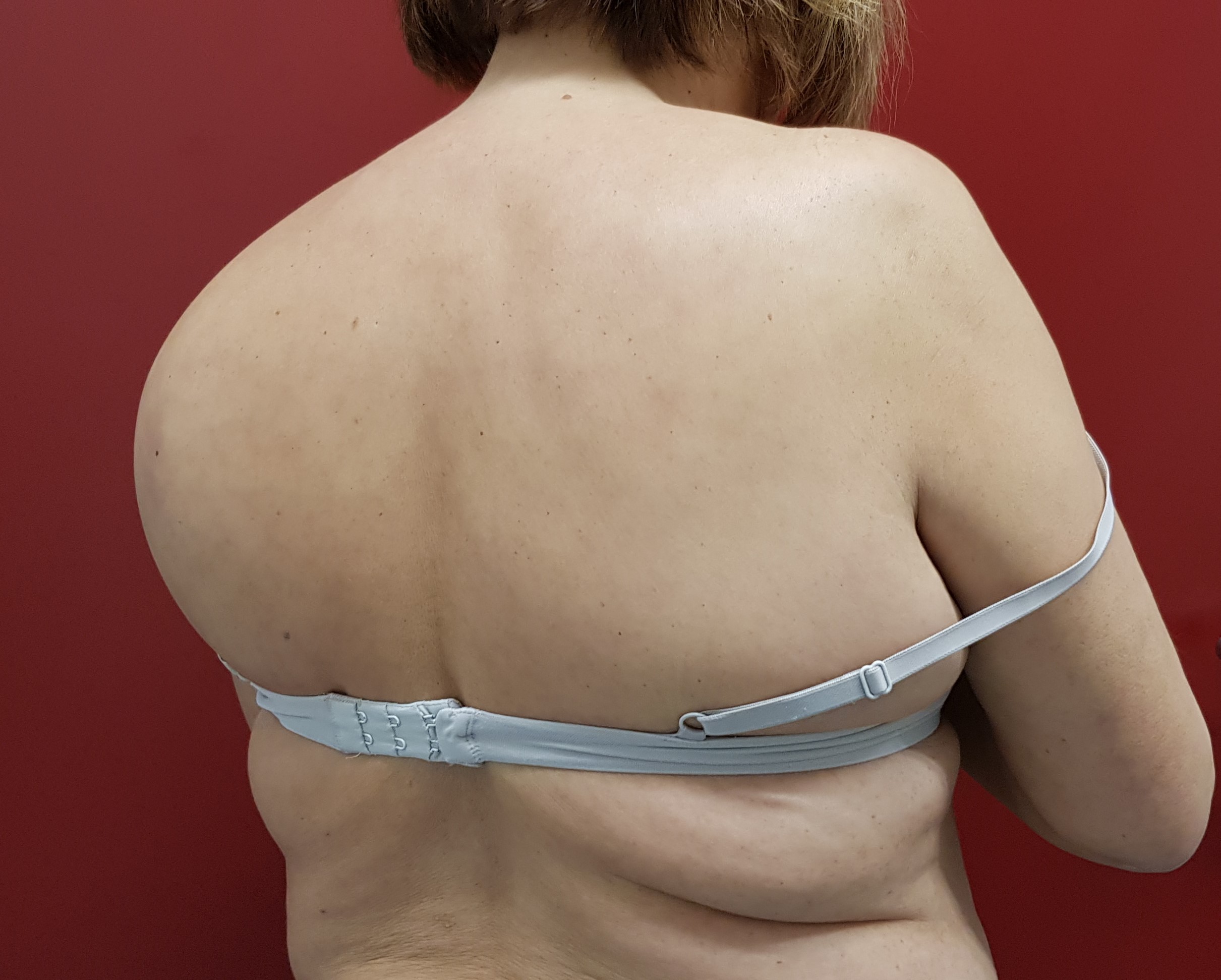
Figura 9:
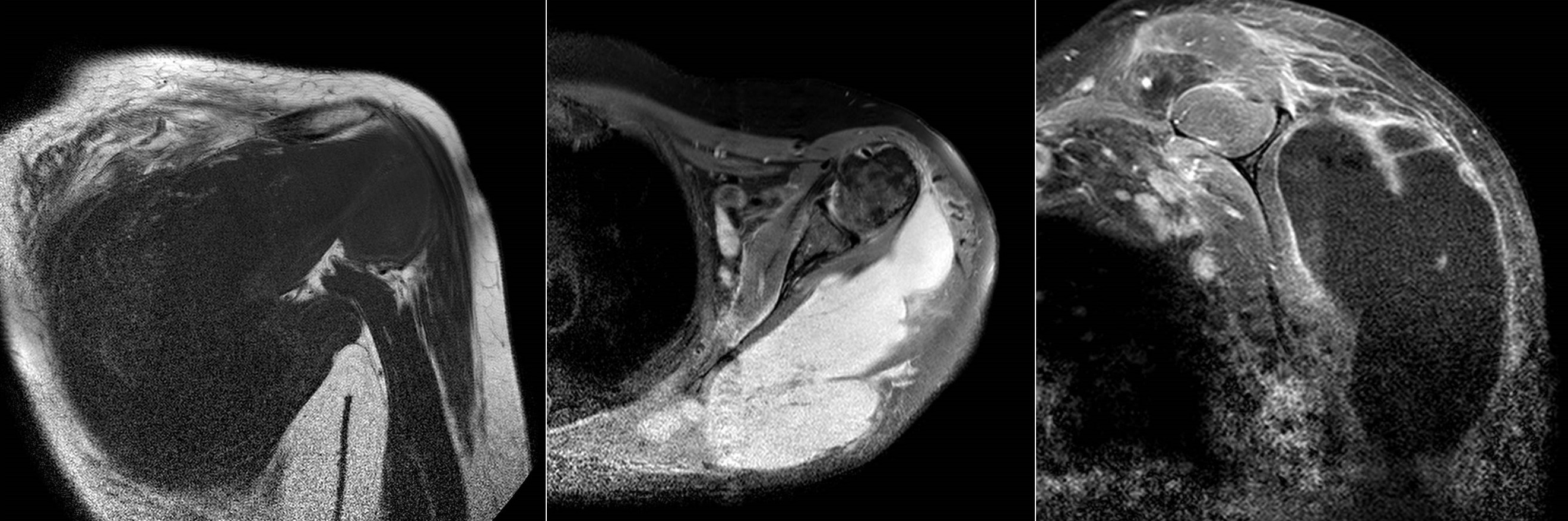
Figura 10:
10. TRATAMIENTO
10.1. Tratamiento general de TPB
El tratamiento de un TPB depende, en primer lugar, de su diagnóstico. Los benignos pueden observarse o extirparse, dependiendo de su sintomatología, localización, capacidad de progresión y riesgo de transformación maligna.
Los malignos deben tratarse en centros especializados, donde las decisiones se toman y ejecutan en equipos multidisciplinarios11,12. Las indicaciones generales dependen de diferentes circunstancias, entre las que están las condiciones del paciente, el tipo tumoral y su estadio, y la resecabilidad del tumor y las posibilidades reconstructivas. El tratamiento estándar de un caso localizado es una resección amplia complementada con radioterapia (RT) y, en casos seleccionados, quimioterapia (QT) y/u otros métodos de tratamiento.
El tratamiento de las resecciones no planificadas y de las recidivas locales sigue principios similares, aunque habría que individualizar cada caso. De la misma manera habría que abordar los casos metastásicos y los SPB inoperables. En muchos de estos escenarios el riesgo de una amputación es mayor.
10.2. Cirugía
La cirugía es el método terapéutico principal en los SPB3. Agrupa métodos conservadores del miembro y amputaciones. Aquéllos se esquematizan en un primer tiempo de resección y en un segundo de reconstrucción del defecto tisular resultante de la resección (Figuras 11 y 12). Ésta, además de atender a otros aspectos técnicos oncológicos generales, debe prestar especial atención al margen quirúrgico, que idealmente debe ser amplio según la clasificación de Enneking. En la actualidad se utilizan también las recomendaciones de la Unión Internacional de Control del Cáncer (UICC)13, que correlaciona la exploración quirúrgica y la patológica y distingue de margen sano (R0), con enfermedad residual microscópica (R1) y con enfermedad residual macroscópica (R2). No obstante, es muy difícil definir un margen como correcto ya que, por ejemplo, la inclusión de una barrera anatómica en aquél se considera más aceptable que un margen mucho más amplio que no la incluye. También habría que considerar la diferente tensión de los tejidos alrededor de la pieza de resección cuando se analiza por el cirujano intraoperatoriamente o por el patólogo en el laboratorio.
Figura 11:
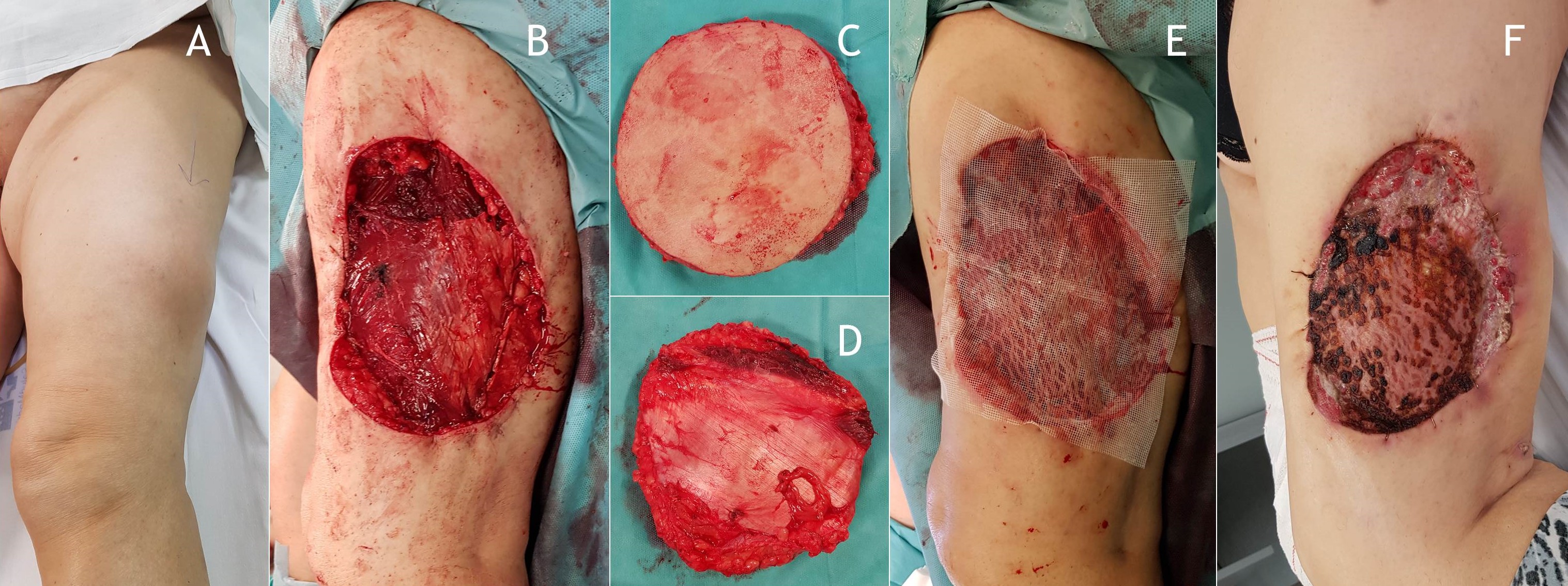
Figura 12:
La reconstrucción, por su parte, podría ser esquelética, vásculo-nerviosa y, obviamente, de las partes blandas necesarias para la cobertura de la herida quirúrgica (Figuras 11 y 12). Esta es fundamental para preservar la apariencia física del segmento corporal y acelerar la rehabilitación con la mejor función y calidad de vida posible; así como para facilitar los tratamientos complementarios de RT y QT, cuando se precisen; y para proteger estructuras vitales que podrían, de otro modo, lesionarse. Las amputaciones están indicadas cuando la resección no puede hacerse con márgenes oncológicos y/o cuando la reconstrucción no es funcional en el tratamiento primario del tumor o como rescate de una recidiva, a veces con fines paliativos.
Figura 11:

Figura 12:

10.3. Radioterapia
La RT está indicada, sobre todo, en SPB profundos de alto grado y tamaño mayor de 5 cm (Figura 13) y/o en casos tratados con resecciones marginales3. Pretende el control local de la enfermedad, que no el aumento de la supervivencia de los pacientes, aceptando que siempre es mejor un margen amplio sin RT que uno positivo con RT. Puede ser externa (pre, intra o postoperatoria) o en forma de braquiterapia; y no está exenta de complicaciones.
Figura 13:
10.4. Quimioterapia
La QT en el tratamiento de los SPB sigue siendo controvertida en su eficacia y régimen de administración (Figura 13)3,14, excepto en los sarcomas de Ewing y en los rabdomiosarcomas, donde prolonga la supervivencia libre de enfermedad y el riesgo de recidiva local disminuye. En general, se considera en pacientes con buen estado general con SPB conocidos con alto riesgo de recidiva local y/o metástasis, o en pacientes que ya las presentan. Finalmente, la antraciclina sigue siendo la terapia sistémica de primera línea para SPB avanzados, aunque se están ensayando nuevos tratamientos dirigidos por el diagnóstico molecular de los casos14.
Figura 13:

11. PRONÓSTICO
El tratamiento multimodal y multidisciplinario de los SPB de las extremidades proporciona un buen control local de la enfermedad y evita amputaciones en la mayoría de los pacientes, con buenos resultados funcionales en términos de calidad de vida3,12. Desde el punto de vista oncológico, aunque dependiendo de muchos factores, las recidivas son más frecuentes en los dos primeros años que sigue a la cirugía (por lo que es recomendable el seguimiento trimestral durante este tiempo en los de más riesgo15). Al cabo de 10 años el porcentaje ronda el 20%. La supervivencia al cabo de este tiempo se estima en un 60% de los casos. Cuando existen metástasis al diagnóstico la supervivencia media se reduce a 22 meses, aunque mejora si se pueden realizar metastasectomías. En los casos de localización en el tronco, tanto el control local como la supervivencia parecen peores que los de las extremidades debido a que suelen diagnosticarse más tarde, es más difícil la resección quirúrgica y parece ser más frecuente la aparición de metástasis pulmonares.
Los factores de riesgo para las recidivas locales se clasifican en intrínsecos y extrínsecos. Entre los primeros están la histología tumoral, su grado histológico y tamaño. Entre los segundos, el estado de los márgenes y la contaminación del lecho quirúrgico15. Atendiendo a todos ellos se deberían establecer protocolos más o menos estrictos. En los pacientes de alto riesgo se recomiendan revisiones al menos trimestrales durante los 2 primeros años15.
Los tumores benignos que han sido resecados serían seguidos con un protocolo similar, dependiendo del tipo y subtipo histológico. Los que están siendo observados serían seguidos un mínimo de 1 año cada 3-6 meses para documentar la falta de progresión y la necesidad de imágenes adicionales o tratamiento.
12. BIBLIOGRAFÍA
1. Tanaka K, Ozaki T. New TNM classification (AJCC eighth edition) of bone and soft tissue sarcomas: JCOG Bone and Soft Tissue Tumor Study Group. Jpn J Clin Oncol. 2019;49(2):103-7.
DOI: https://doi.org/10.1093/jjco/hyy157
2. Kallen ME, Hornick JL. The 2020 WHO classification: What´s new in soft tissue tumor pathlogy? Am J Surg Pathol. 2020;Aug 12.
DOI: https://doi.org/10.1097/PAS.0000000000001552
3. Ramos Pascua LR, Díaz Martín A, López Goenaga J, Mellado Romero MA, Casas Ramos P. Tumores de partes blandas. En: Traumatología y Ortopedia. Generalidades (Gómez Barrena E, ed). Elsevier España SLU, Barcelona, 2020:324-32.
4. Schaefer IM, Hornick JL. Diagnostic immunohistochemistry for soft tissue and bone tumors: An update. Adv Anat Pathol. 2018;25(6):400-12.
DOI: https://doi.org/10.1097/PAP.0000000000000204
5. Steffner RJ, Jang ES. Staging of bone and soft-tissue sarcomas. J Am Acad Orthop Surg. 2018;26(13):e269-e278.
DOI: https://doi.org/10.5435/JAAOS-D-17-00055
6. Kikuta K, Nakayama R, Yamaguchi S, Nishiwaki Y, Susa M, Nishimoto K, et al. Wide-spread ignorance on the treatment of subcutaneous malignant tumors; a questionnaire-based study. Jpn J Clin Oncol. 2018;48(2):130-4.
DOI: https://doi.org/10.1093/jjco/hyx184
7. Thway K, Folpe AL, Update on selected advances in the immunohistochemical and molecular genetic analysis of soft tissue tumors. Virchows Archiv. 2020;476:3-15.
DOI: https://doi.org/10.1007/s00428-019-02678-7
8. Fenzl L, Bubel K, Mehrmann M, Scheneider G. Imaging and biopsy of soft tissue tumors. Radiologe. 2018;58(1):79-92.
DOI: https://doi.org/10.1007/s00117-017-0331-y
9. Lisson CS, Lisson CG, Beer M, Schmidt SA. Radilogical diagnosis of soft tissue tumors in adults: MRI imaging of selected entities delineating benign and malignant tumors. Rofo. 2019;191(4):323-32.
DOI: https://doi.org/10.1055/a-0715-2205
10. Kuhn KJ, Cloutier JM, Boutin RD, Steffner R, Riley G. Soft tissue pathology for the radiologist: a tumor board primer with 2020 WHO classification update. Skeletal Radiol. 2020 Aug 2.
DOI: https://doi.org/10.1007/s00256-020-03567-w
11. Awad N, Lackman R, McMackin K, Kim TW, Lombardi J, Caputo F. Multidisciplinary approach to treatment of soft tissue sarcomas requiring complex oncologic resections. Ann Vasc Surg. 2018;53:212-6.
DOI: https://doi.org/10.1016/j.avsg.2018.04.035
12. Gómez J, Tsagozis P. Multidisciplinary treatment of soft tissue sarcomas: An update. World J Clin Oncol. 2020;11(4):180-9.
DOI: https://doi.org/10.5306/wjco.v11.i4.180
13. Stoeckle E, Coindre JM, Kind M, Kantor G, Bui BN. Evaluating surgery quality in soft tissue sarcoma. Recent Results Cancer Res. 2009;179:229–42.
DOI: https://doi.org/10.5306/wjco.v11.i4.180
14. Smrke A, Wang Y, Simmons C. Update on systemic therapy for advanced soft-tissue sarcoma. Curr Oncol. 2020;27(Suppl 1):25-33.
DOI: https://doi.org/10.3747/co.27.5475
15. Ezuddin NS, Pretell-Mazzini J, Yechieli RL, Kerr DA, Wilky BA, Subhawong TyK. Local recurrence of soft-tissue sarcoma: issues in imaging surveillance strategy. Skeletal Radiol. 2018;47(12):1595-606.
DOI: https://doi.org/10.1007/s00256-018-2965-x
13. FIGURAS
Figura 1: Localización e incidencia de SPB por subtipo histológico en la serie del Hospital de Sant Pau de Barcelona (años 2005-2016).

Figura 2: Aspecto clínico de un lipoma subcutáneo (A) y de un sarcoma de partes blandas profundo (B).

Figura 3: Secuencias y cortes coronal y axial de RM en sarcoma de células claras de alto grado en compartimento anterior del muslo.

Figura 4: Secuencia de biopsia con aguja gruesa (trucut) guiada por ecografía en un tumor de partes blandas del muslo.

Figura 5: Varón de 62 años de edad con tumoración en la partes proximal del gemelo interno de su pierna derecha que la RM informaba como muy probable sarcoma de partes blandas (círculo blanco). Se realizó biopsia con aguja gruesa guiada por ecografía que no fue concluyente, aunque descartaba malignidad. Para más seguridad se decidió realizar resección amplia de la tumoración.

Figura 6: A) Pieza de resección con márgenes amplios del caso de la figura 5, que resultó ser una vena trombosada. B) Aspecto macroscópico de la vena trombosada (flecha). C) Trombo adherido a la pared de la vena (asterisco blanco). El asterisco negro señala el resto de la luz de la vena (X20). D) Se observa un cierto componente inflamatorio linfocitario (X40).

Figura 7: Hematoma en el que clínicamente se había sospechado un sarcoma de partes blandas. A) En la parte izquierda de la imagen se observa la cápsula de tejido fibroso y, debajo de ella, fibrina (X20). B) A mayor aumento se identifican células correspondientes a histiocitos (X40).

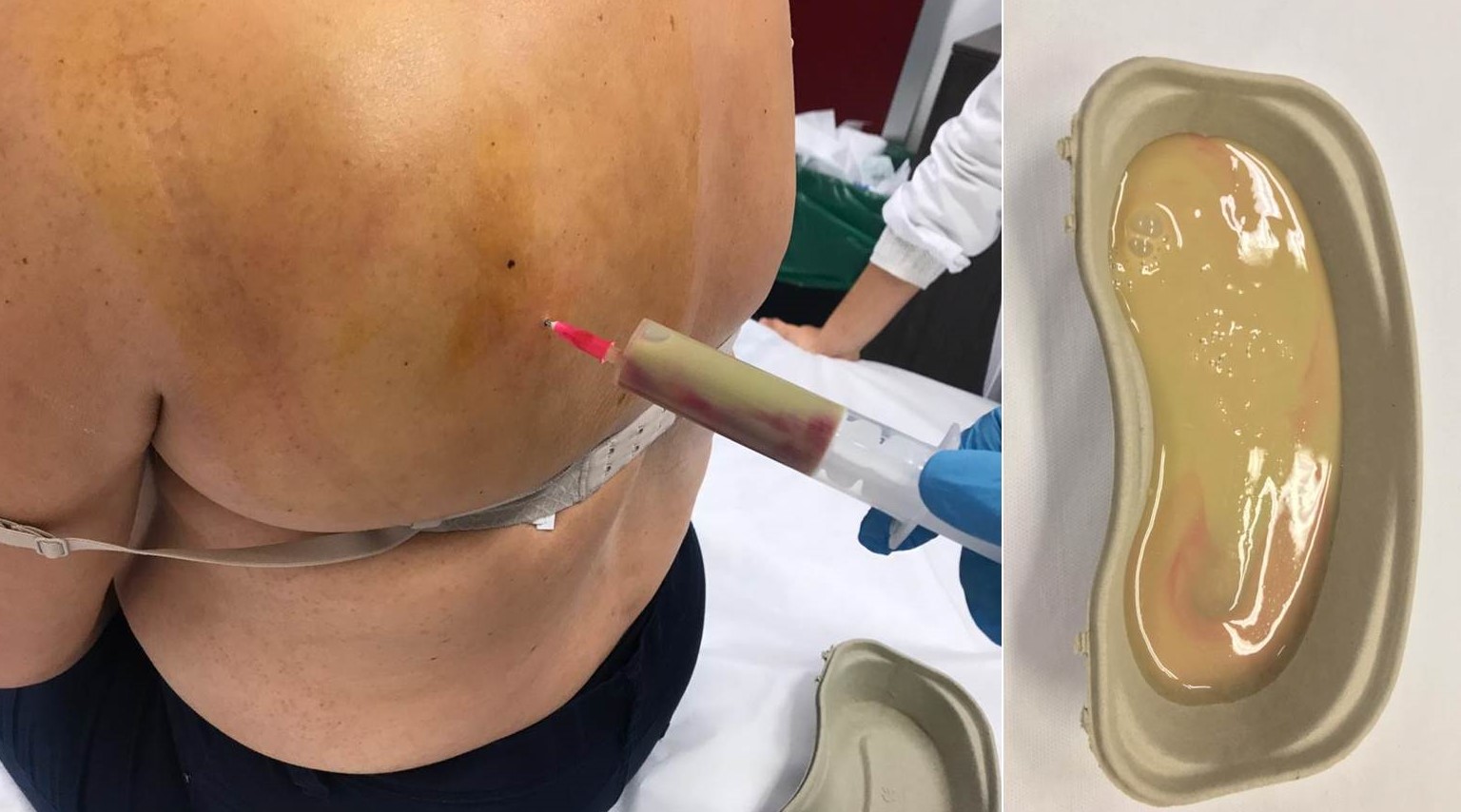
Figura 8: Mujer de 53 años de edad con tumoración de partes blandas en la cintura escapular que correspondió a un absceso.

Figura 9: RM del caso de la figura 8.

Figura 10: Punción de la tumoración del caso de las figuras 8 y 9, observándose el material purulento del absceso.

Figura 11: Sarcoma de partes blandas (mixofibrosarcoma) subcutáneo del muslo y secuencia del tratamiento quirúrgico realizado: resección amplia incluyendo piel en superficie y fascia en profundidad; y reconstrucción con autoinjerto de piel libre.

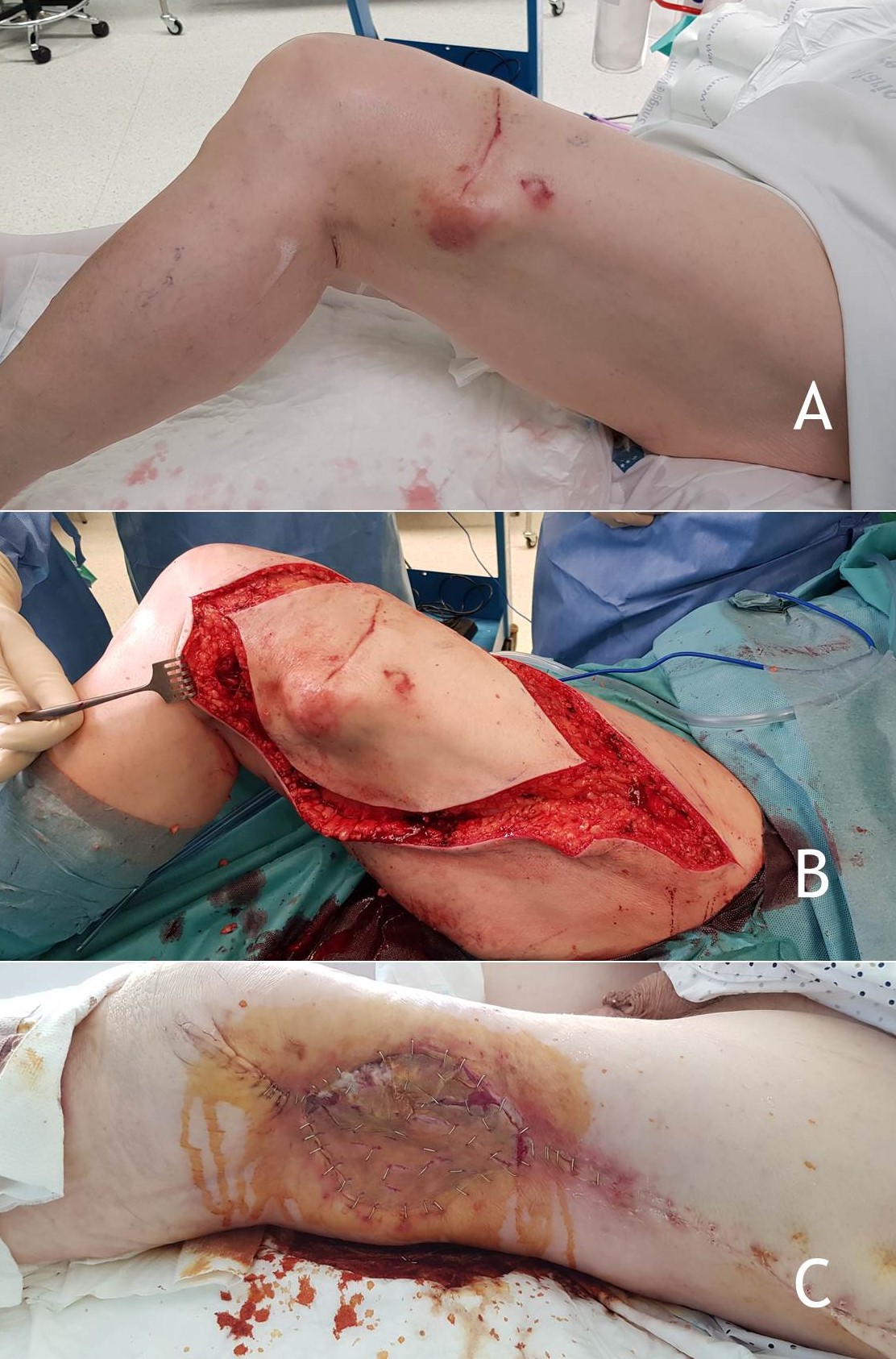
Figura 12: Sarcoma pleomórfico indiferenciado remitido después de una resección subtotal por la vía de la imagen. Se completó la resección incluyendo en la pieza el trayecto y las partes blandas contaminadas de la cirugía previa. Se colocó un sistema VAC y, posteriormente, un colgajo de piel libre.

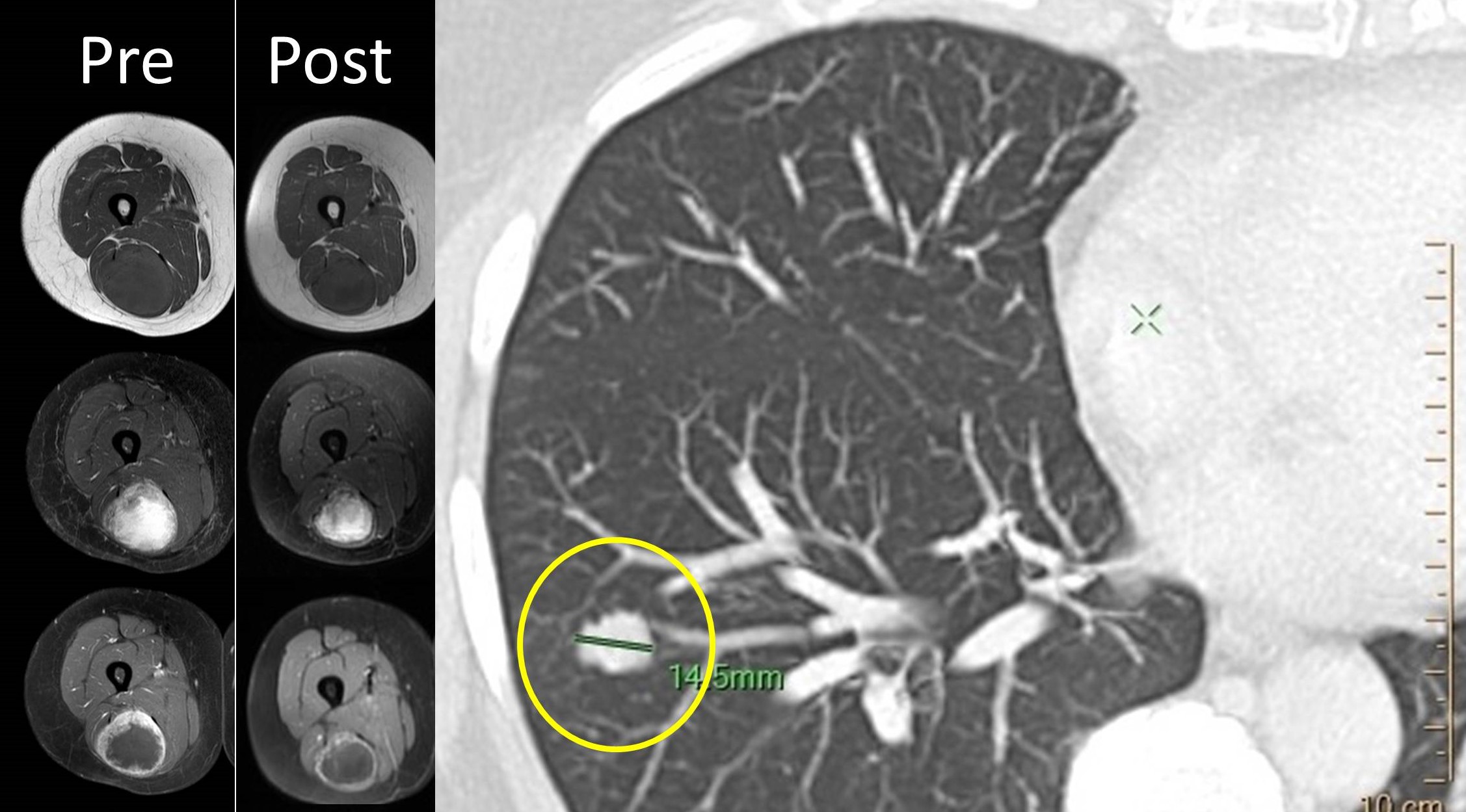
Figura 13: Mujer de 57 años de edad con sarcoma pleomórfico indiferenciado del compartimento posterior del muslo estadio IIIB. Se decidió radioterapia y quimioterapia neoadyuvante, que redujeron el volumen tumoral de 10x7,2x6,5 cm a 10x5,7x5,2 cm (L,T y AP) a expensas fundamentalmente del amplio centro necrótico; y resección quirúrgica posterior. Un año y medio más tarde aparecieron metástasis pulmonares que se extirparon (círculo amarillo).
