
TEORÍA
8.1.2. CONDROMATOSIS SINOVIAL
Autores
1. Ramos Pascua, Luis Rafaela,c
2. Ortiz Cruz, Eduardo J.a,d
3. Pozo Kreilinger, José Juanb,d
4. Enguita Valls, Ana Belénb,c
Especialidad
aCirugía Ortopédica y Traumatología
bAnatomía Patológica
Centro
cHospital Universitario 12 de Octubre, Madrid
dHospital Universitario La Paz, Madrid
1. DEFINICIÓN
La condromatosis sinovial (CS) es una proliferación condroide benigna del tejido sinovial discutida como metaplasia o neoplasia. Fue inicialmente descrita en la rodilla en 1558 por Ambrosio Paré y en 1813 como cuerpos libres intra-articulares en los tejidos subsinoviales por Laennac1. Su descripción actual se atribuye a Jaffe, en 19582. También se la conoce como osteocondromatosis sinovial, condrosis sinovial, síndrome de Reichel, síndrome de Reichel-Jones-Henderson o condrometaplasia sinovial. El término osteocondromatosis sinovial no refleja el aspecto patológico en todos los casos puesto que la osificación endocondral no está presente en todos los nódulos de cartílago3. Por otra parte, para las formas extraarticulares también se ha empleado la terminología “osteocondroma sinovial” y “osteocondromatosis sinovial solitaria”4.
2. CLASIFICACIÓN
CIE 10: Q78.6.
CIE 9: 238.0.
Existen formas primarias o idiopáticas, que ocurren en cualquier articulación, y formas secundarias. También se puede clasificar en formas intraarticulares y extraarticulares (tenosinoviales, en bolsas serosas y vainas tendinosas).
3. DEMOGRAFÍA
3.1. Incidencia: La incidencia exacta se desconoce, pero se calcula 1.8 casos por millón de habitantes y año1. Las formas secundarias son más frecuentes que las primarias.
3.2. Sexo: Es de 1.8 a 3 veces más frecuente en varones. Sin embargo, las formas extraarticulares en pacientes mayores de 50 años predominan en mujeres, con una relación de 2:13.
3.3. Edad: Generalmente de 30-60 años de edad1. Las formas primarias suelen diagnosticarse a edad más temprana que las secundarias, habitualmente en la tercera o cuarta décadas de la vida. Las formas extraarticulares suelen afectar a pacientes mayores de 20 años de edad, con una edad media de 46 años3.
3.4. Localización: Suele afectar de forma típica a grandes articulaciones diartrodiales de carga, sobre todo a la rodilla (50-70%) y la cadera (20%). Otras localizaciones habituales, en orden de frecuencia, son el hombro5, el codo6, el tobillo7,8 y la muñeca1. También se han publicado casos en las facetas articulares intervertebrales, en la témporo-mandibular, metacarpo-falángicas, interfalángicas, etc. De la misma manera se han descrito localizaciones tenosinoviales, que suelen afectar a manos (57%), pies (22%), muñecas (11%) y tobillos (5%)3. La localización más frecuente de la condromatosis tenosinovial son los tendones flexores de los dedos5. En el 5-10% de los casos es bilateral, sobre todo en las rodillas y en las formas primarias.
4. ETIOPATOGENIA
La CS se ha considerado clásicamente una metaplasia, sin atipias ni invasión tisular, en la que se desarrollan focos cartilaginosos en las membranas sinoviales de articulaciones sinoviales, bursas y vainas tendinosas. En la actualidad, no obstante, se considera más una patología neoplásica debido a que se identifican cambios cromosómicos5,9,10. También existen publicaciones raras de asociaciones familiares (2% de los casos)3. De cualquier forma, la causa concreta sigue sin conocerse.
Los focos de CS inicialmente se desarrollan como cuerpos cartilaginosos sésiles manteniendo el contacto con la sinovial subyacente. Después, se desprenden convirtiéndose en cuerpos libres intra o periarticulares. La mayoría de los cuerpos libres se producen en la zona de transición entre la membrana sinovial y el cartílago articular, probablemente debido a la alta densidad de células madre pluripotenciales que asientan allí. Una vez libres, los cuerpos se nutren del líquido sinovial y continúan creciendo, aunque también pueden volver a adherirse a la membrana sinovial o hasta reabsorberse.
La CS sinovial primaria se entiende como idiopática, mientras que la secundaria se asocia a patologías intraarticulares que causan daño articular y sinovitis. Estas son propias de pacientes en la quinta o sexta décadas de la vida por artrosis, traumatismos articulares (simple o repetidos), osteocondritis disecante, artropatías de Charcot u osteonecrosis avanzada1.
La historia natural de la CS tiende a ser crónica y progresiva, pudiendo causar en formas de diagnóstico tardío daños articulares irreversibles. Aunque con poco interés clínico y terapéutico, se han descrito 3 fases de la enfermedad, entendiéndola como autolimitada11: estadio I (precoz, activo, sin cuerpos libres), estadio II (proliferación sinovial activa con cuerpos libres transicionales) y estadio III (tardío con cuerpos libres múltiples con enfermedad sinovial mínima). Independientemente de que sea una entidad de origen metaplásico o neoplásico, también es posible la malignización. En el otro extremo, como se ha adelantado, también puede ocurrir la resolución espontánea de una CS.
5. PRESENTACIÓN CLÍNICA
La CS tiene una presentación inespecífica y a menudo se diagnostica de forma incidental (sobre todo en el estadio III, quiescente)8. Cuando es sintomática suele presentarse con síntomas insidiosos tales como dolor (85-100% de los casos), tumefacción (42-58%) -Figuras 1 y 2- y limitación de la movilidad (38-55%)3. También puede haber crepitación (20-33%), bloqueos (5-12%), masa o nódulos palpables (3-20%) y amiotrofia muscular (hasta en el 21% de los casos)1,3. Los síntomas mecánicos pueden ser del tipo de dolor mecánico, masa palpable y dolor selectivo en la interlínea articular. Menos frecuente es la sensación de inestabilidad o el compromiso de estructuras neurovasculares. Por todo ello la impotencia funcional es variable, si bien suele ser más común en formas de la cadera y el codo.
En las formas extraarticulares los síntomas habituales son una tumoración indolora o con molestias leves a la palpación3.
Figura 1:
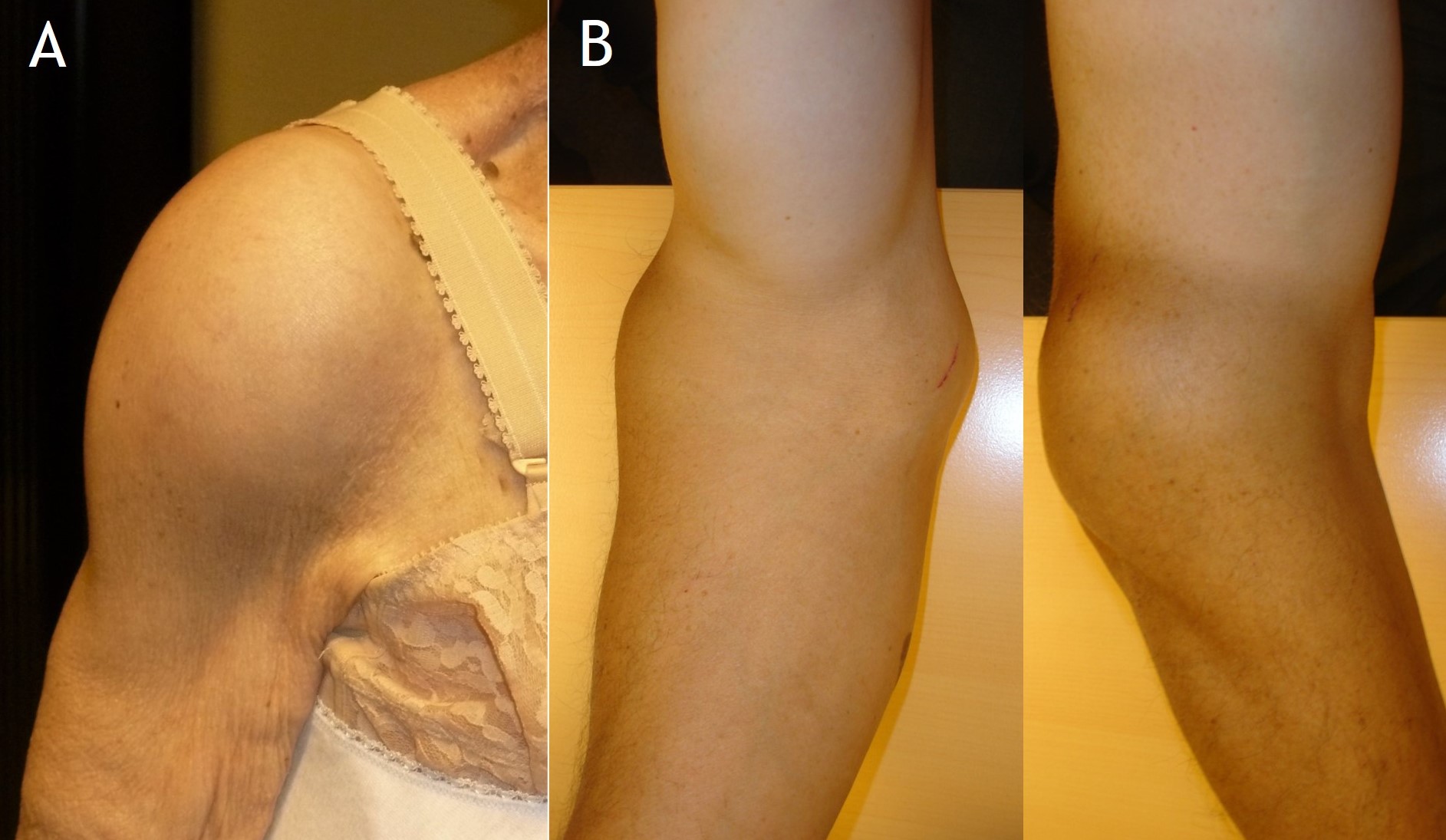
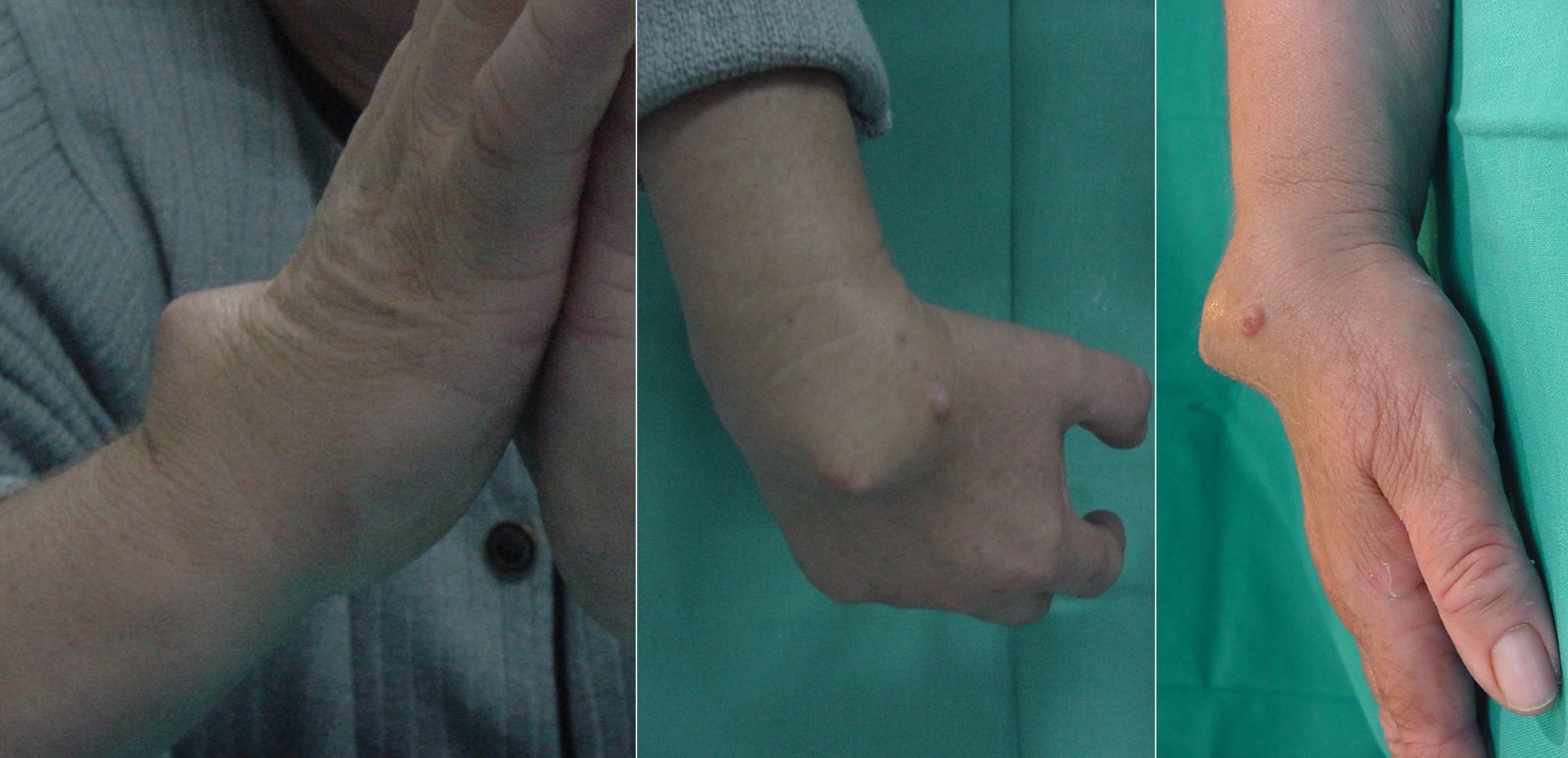
Figura 2:
6. PRUEBAS DE LABORATORIO
No son específicas.
7. PRUEBAS DE IMAGEN
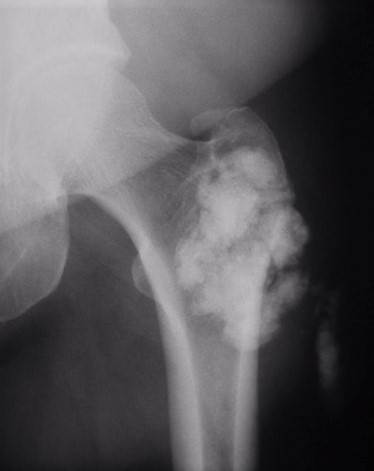
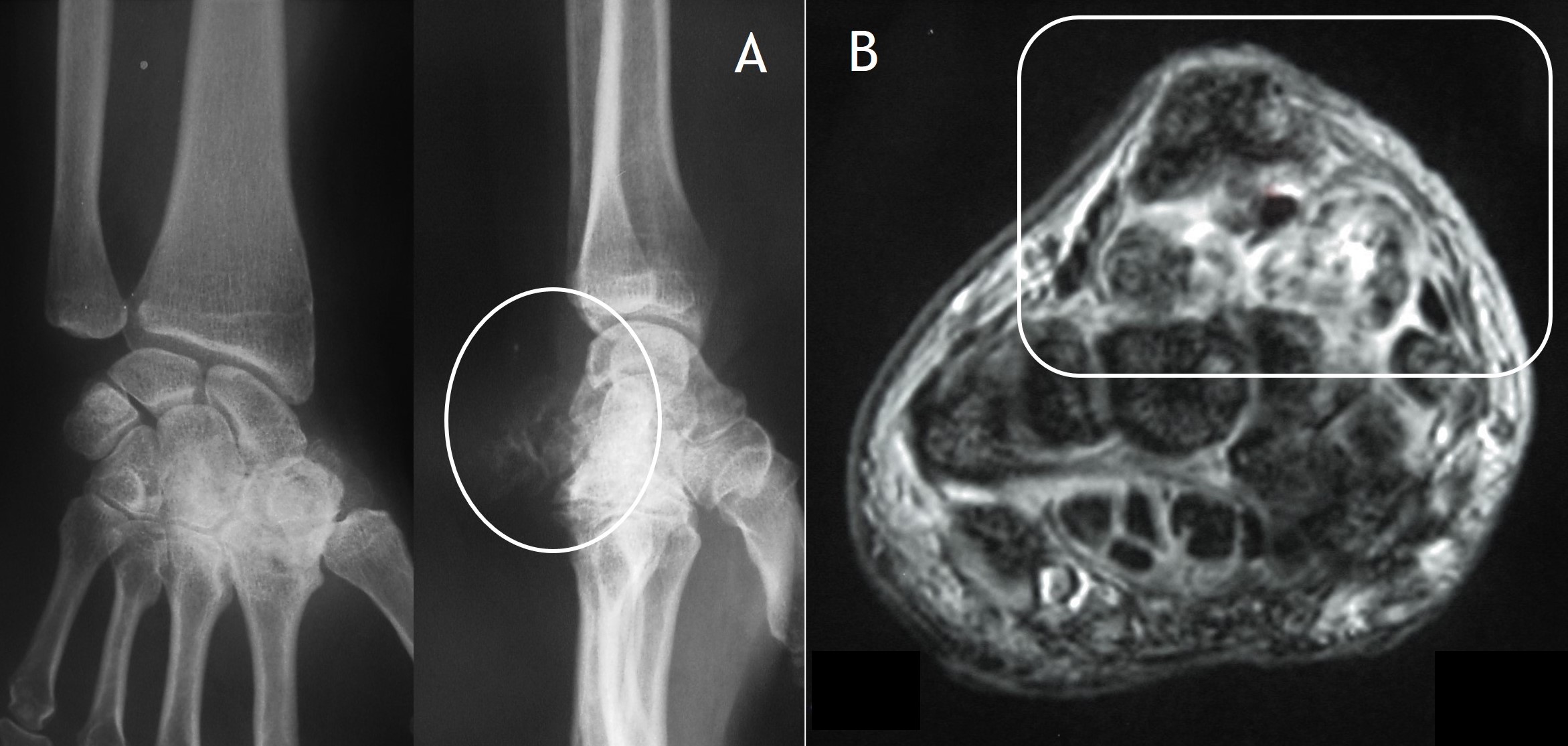
7.1. Radiología simple: Aunque las radiografías son normales en el 5-30% de las CS primarias, la enfermedad suele mostrar hallazgos que se consideran diagnósticos, como sería la observación de múltiples densidades esféricas calcificadas multifocales articulares o periarticulares (Figuras 3-6). Estas calcificaciones se identifican en el 70-95% de los casos de condromatosis sinoviales primarias3. Ocasionalmente presentan un borde externo densamente calcificado y una radiolucencia central, típica de los estadios II y III de la CS (Figura 5). También es frecuente un patrón de mineralización típico en anillos y arcos. A veces los cuerpos libres condrales se unen y forman una gran masa mineralizada. El 20% de los casos, sin embargo, no muestran calcificaciones porque todavía no ha ocurrido la mineralización de los nódulos del tejido sinovial. Se podría evidenciar la tumefacción articular, erosiones extrínsecas en el hueso (generalmente en ambos extremos articulares de articulaciones estrechas, como pueden ser la cadera o el hombro) y hasta una osteopenia yuxtaarticular por el desuso3. El espacio articular típicamente se mantiene, salvo que se haya desarrollado una artrosis secundaria. El aspecto radiográfico de las formas extraarticulares es similar al de las intraarticulares, revelando la distribución de la calcificación la anatomía de una bursa afectada (Figura 6). En los casos de las vainas tendinosas la mineralización sería ovalada o elongada3. En la CS secundaria los fragmentos osteocondrales son menores o más variables en tamaño, además de menos en número; asociándose a los hallazgos radiográficos de la enfermedad de base.
Figura 3:
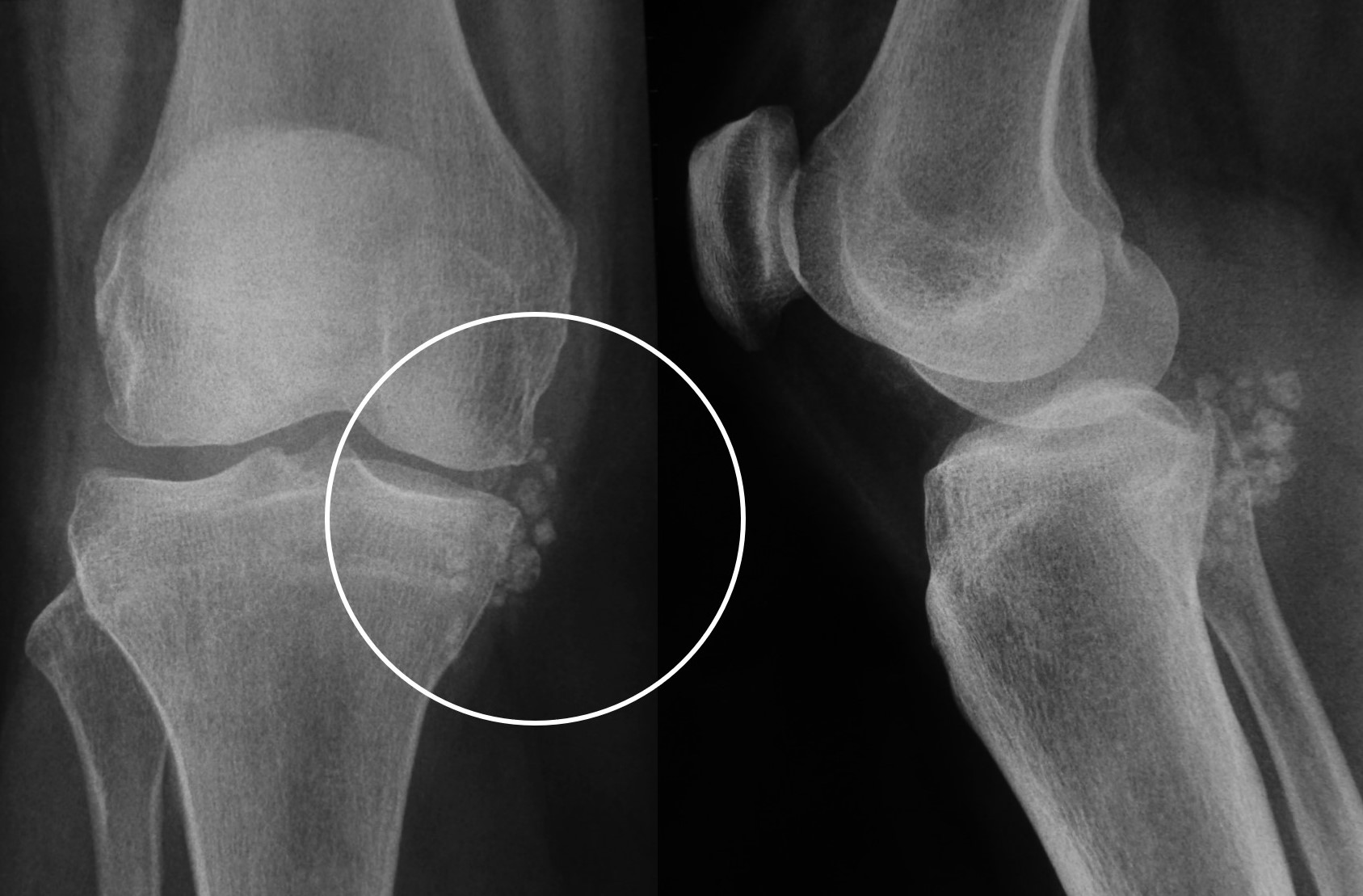
Figura 4:
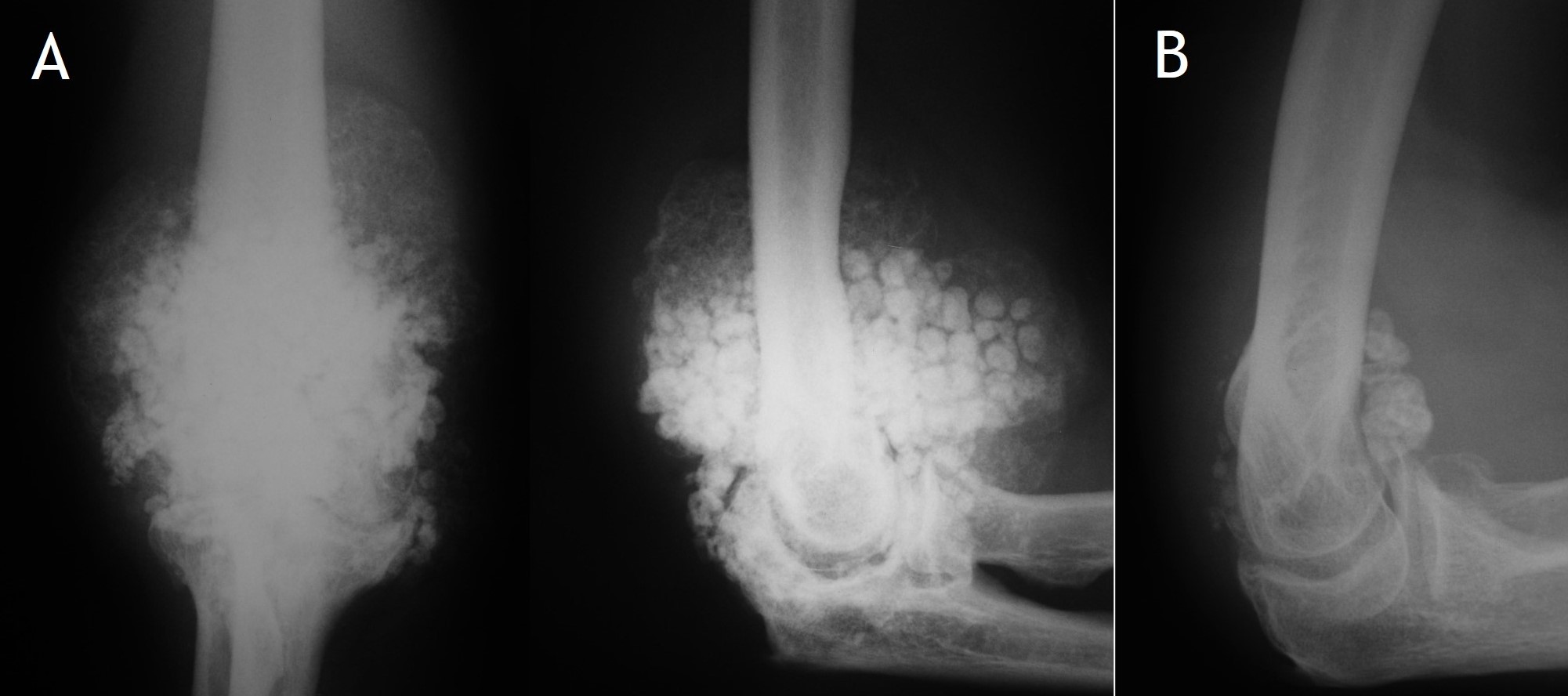
Figura 5:
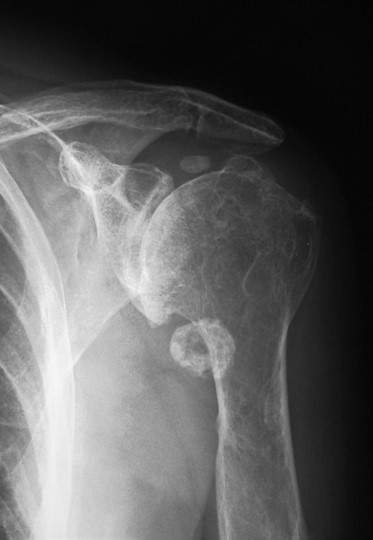
Figura 6:
7.2. Artrografía: Defectos circulares de relleno correspondientes a los cuerpos condrales intraarticulares.
7.3. Ecografía: Masa heterogénea con focos de hiperecogenicidad. Estos focos hiperecoicos representan fragmentos condrales o zonas sinoviales con formación de nódulos cartilaginosos. Sin embargo, una mineralización extensa puede ocultar hallazgos más característicos de contornos lobulillares y la multiplicidad de los cuerpos condrales3. Dependiendo de la localización, los fragmentos pueden cambiar de posición durante la exploración dinámica, lo que es un signo útil para el diagnóstico de cuerpos libres. El eco-Doppler revelaría un proceso avascular3.
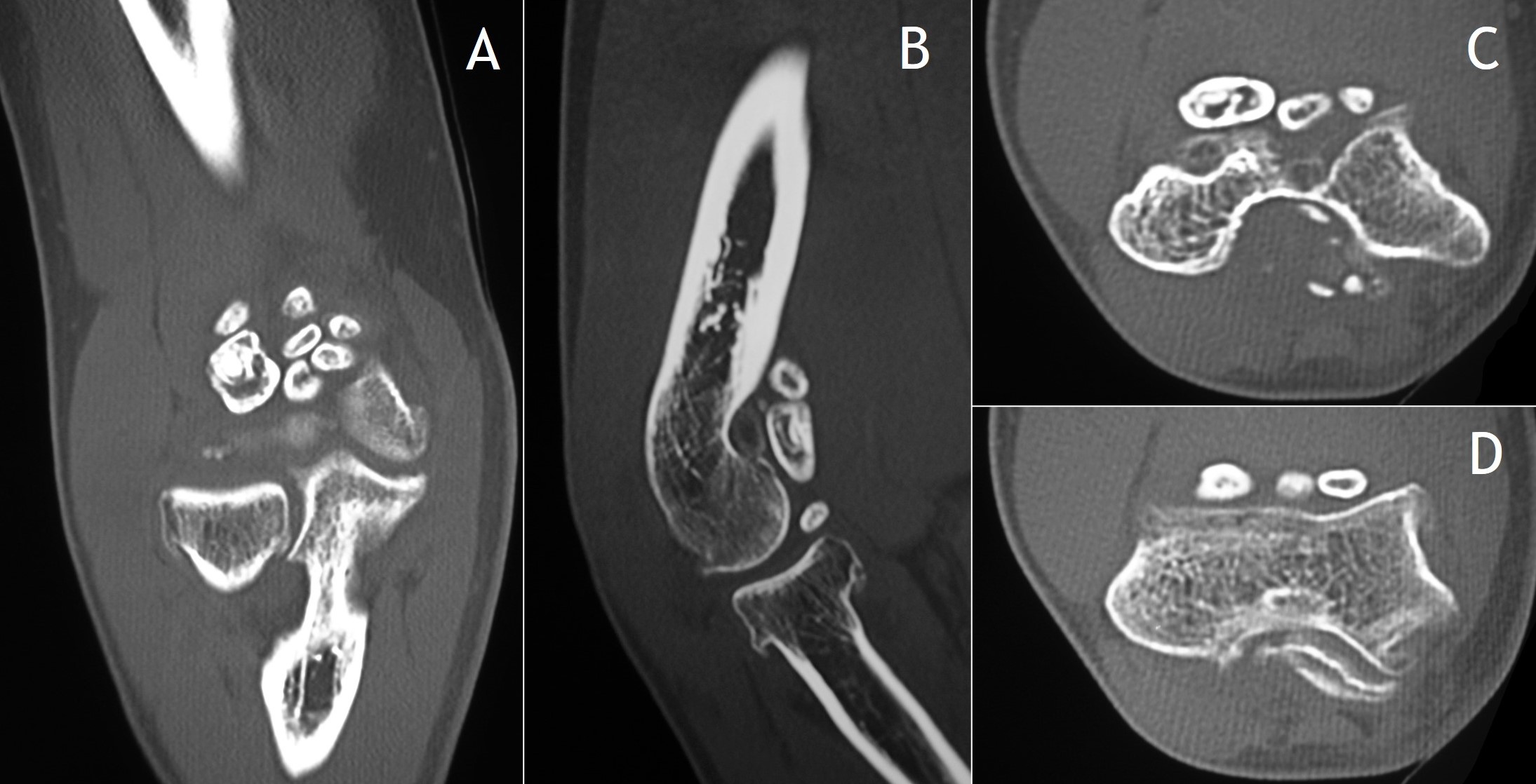
7.4. TC: De mucha utilidad, al igual que la RM, en la fase premineralización de la CS1. No obstante, descubre mejor que la RM las áreas mineralizadas. De hecho, es de elección para identificar y caracterizar calcificaciones, áreas de osificación endocondral y erosiones extrínsecas del hueso (Figura 7)2. Es particularmente útil en casos en los que el estudio radiográfico es normal o equívoco debido a una anatomía ósea compleja, como puede ser la de la cadera o la de la articulación témporo-mandibular. Se puede ver captación periférica y septal tras la administración de contraste intravenoso debido a la vascularización de la membrana sinovial y de los septos fibrosos entre los nódulos cartilaginosos, relativamente avasculares.
Figura 7:
7.5. RM: En secuencias ponderadas en T1 los cuerpos libres se presentan con una baja intensidad de señal, aunque más alta que la del músculo. En T2 tienen alta intensidad de señal, típico del cartílago por su alto contenido en agua, tanto en formas intraarticulares (Figuras 8 y 9) como extraarticulares (Figura 10)4. Las áreas de mineralización son hipointensas en todas las secuencias. Por otra parte, como también la TC, la RM evalúa mejor la extensión de las lesiones a las estructuras adyacentes. Clásicamente se distinguen tres patrones, siendo el más frecuente el descrito. El segundo, que se observa en el 14% de los casos, es similar, sin áreas focales intraarticulares de intensidad de baja señal (correspondiente al estadio I de la enfermedad) ni calcificaciones en Rx o TC. El 9% de los casos muestran un tercer patrón en el que se identifican focos isointensos con respecto a la grasa de alta intensidad con un anillo periférico de baja intensidad de señal. Este patrón se corresponde a focos de osificación endocondral en Rx o TC.
Figura 8:
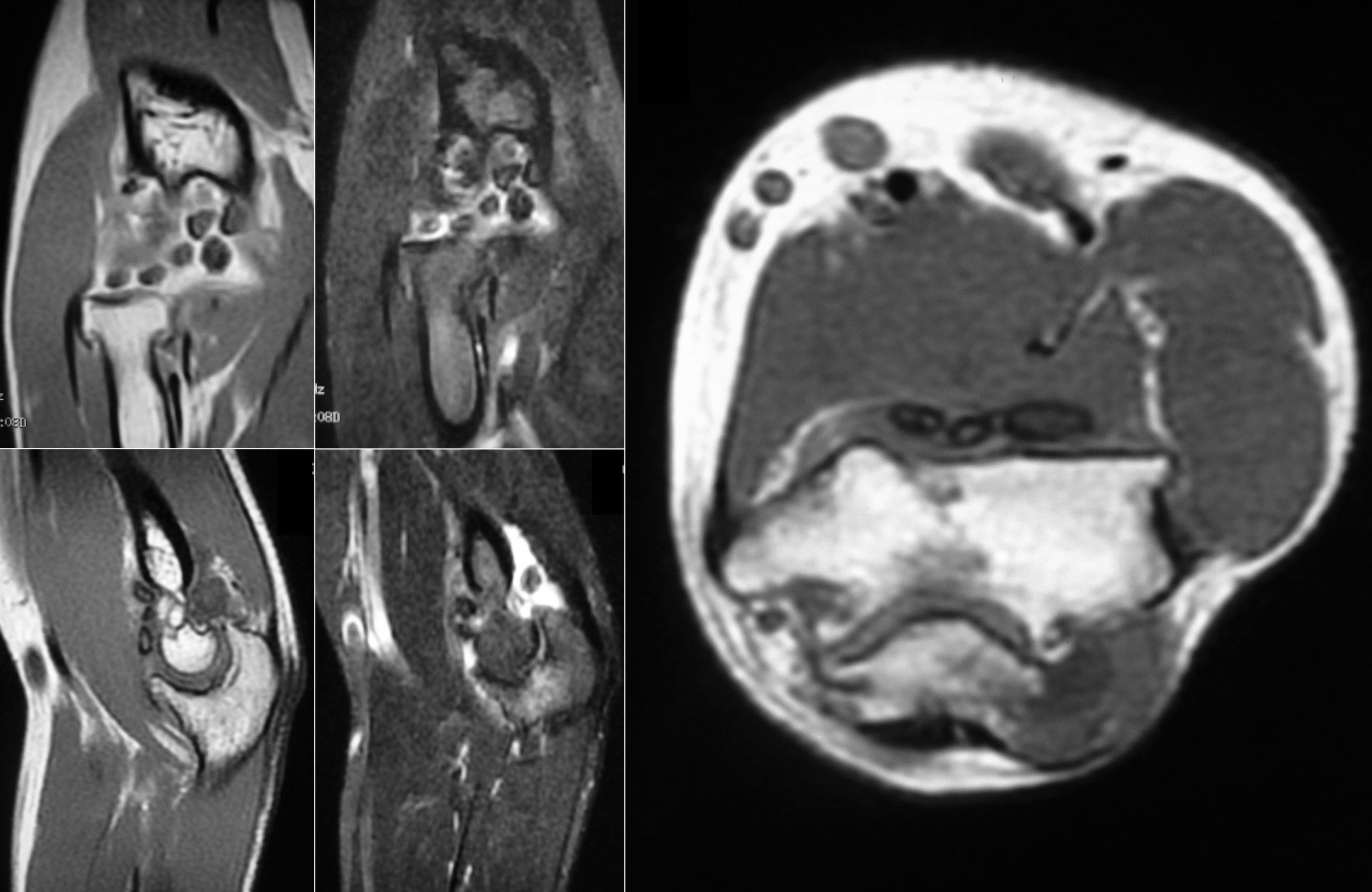
Figura 9:
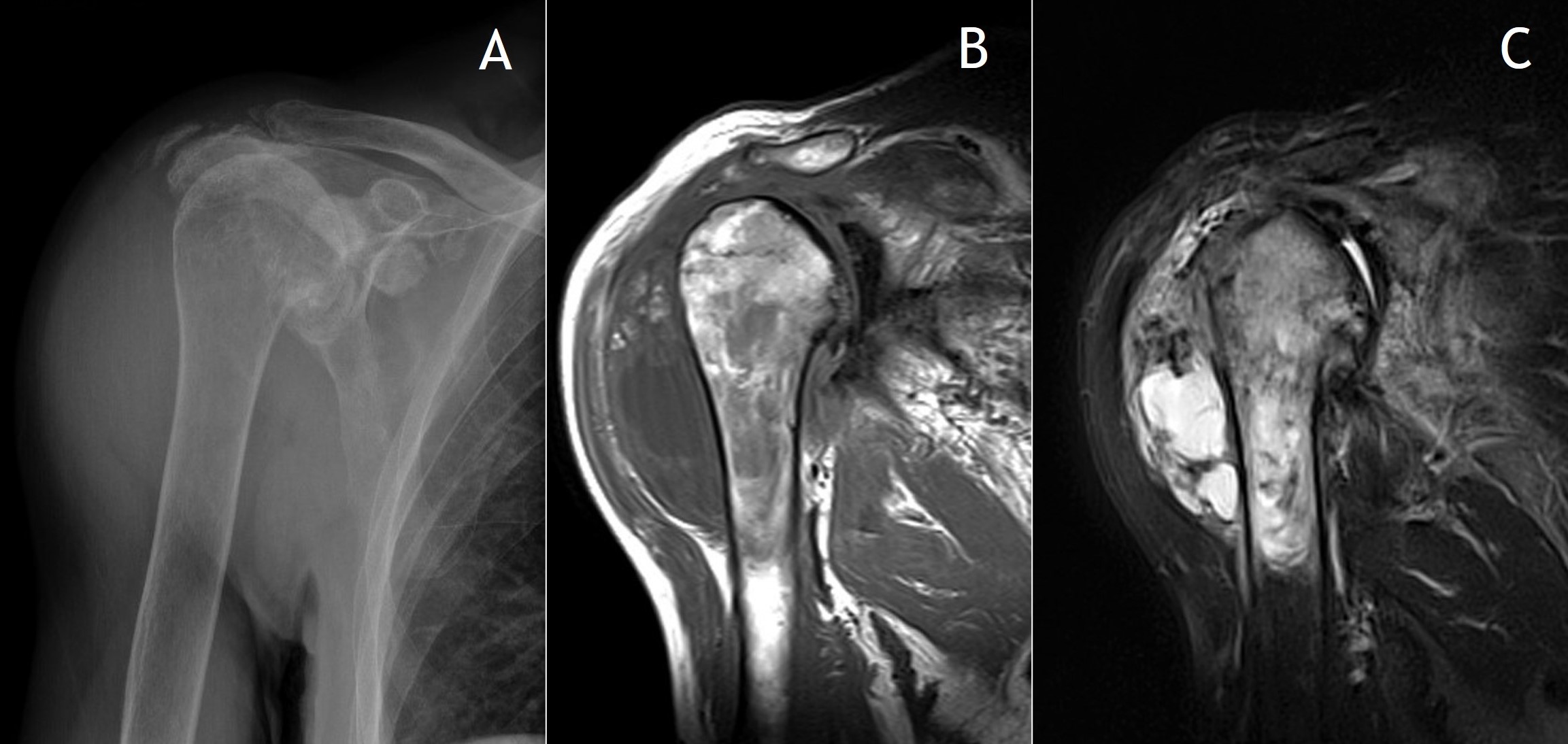
Figura 10:
La captación de contraste en la CS primaria es la típica de los tumores de cartílago hialino, con un característico patrón periférico y septal. Las regiones sin captación representan las áreas multilobuladas de nódulos de cartílago hialino.
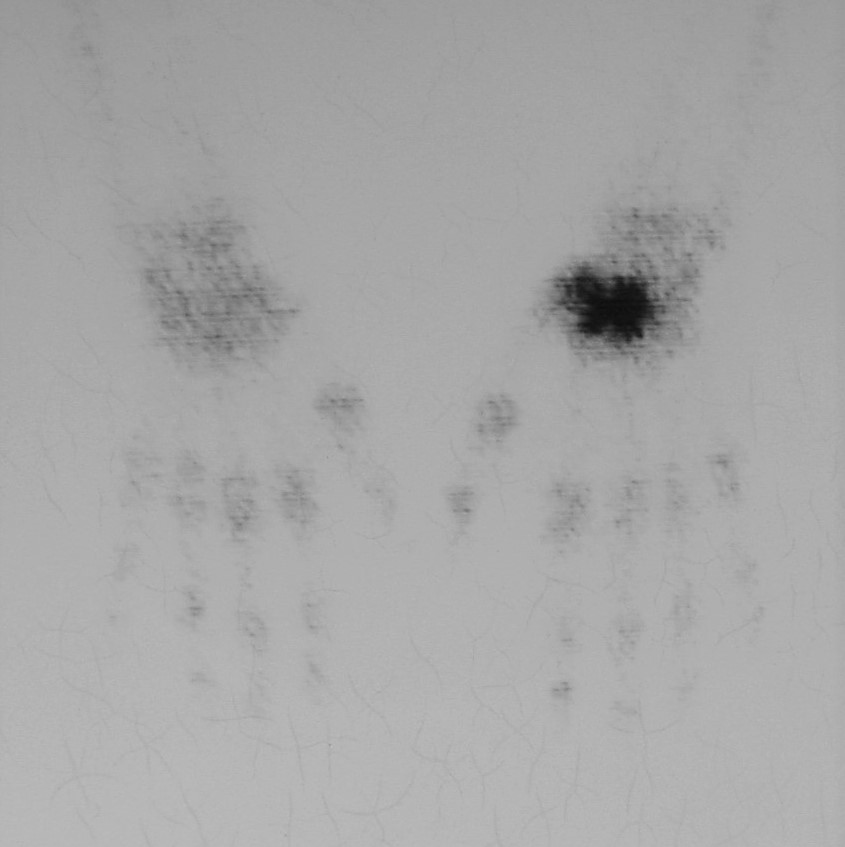
7.6. Gammagrafía: Captación prominente inespecífica del radionúclido (Figura 11).
Figura 11:
8. ANATOMÍA PATOLÓGICA
8.1. Macroscopía: Nódulos cartilaginosos polipoideos brillantes, de coloración blanco-grisácea. Los nódulos pueden variar en número (desde varios a más de 1000) y tamaño. La CS primaria cursa con cuerpos libres que tienden a ser pequeños, redondos y de tamaño uniforme. Los cuerpos libres de las formas secundarias suelen ser de tamaño variable, aunque generalmente más grandes y de forma más irregular. También suelen ser menos numerosos. La membrana sinovial suele mostrarse engrosada e hiperémica. Los nódulos de cartílago pueden extenderse a los tejidos blandos adyacentes y a las bursas, y pueden erosionar el hueso vecino. El aspecto macroscópico de las formas extraarticulares es idéntico al de las formas intraarticulares.
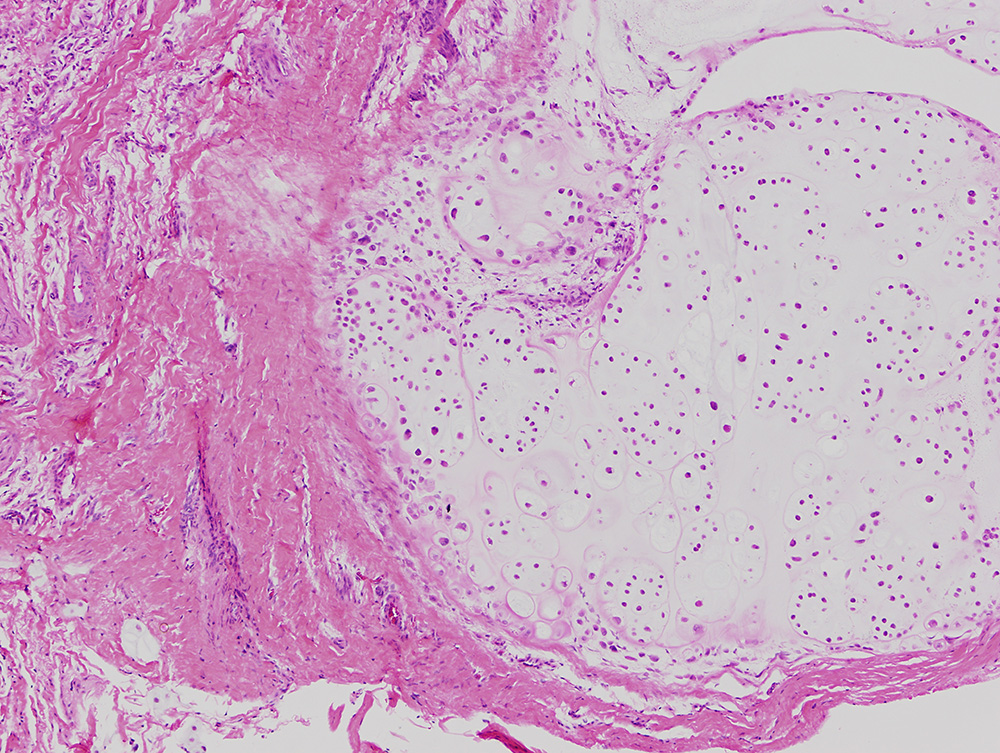
8.2. Microscopía: Nódulos cartilaginosos hipercelulares agrupados en nidos o clones bien delimitados, libres o adheridos a la membrana sinovial, rodeados de un revestimiento sinovial (con una capa celular doble de epitelio cuboideo)3 -Figura 12-. El cartílago es hialino y los grados de calcificación y osificación, variables. En la condromatosis sinovial secundaria puede haber osificación endocondral periférica (que puede progresar para contener médula amarilla central), así como proliferación sinovial. También en el centro de los lóbulos puede observarse mineralización distrófica.
Figura 12:
8.3. Inmunohistoquímica: No aporta datos significativos para el diagnóstico de la entidad.
8.4. Citogenética: Alta incidencia de la fusión génica fibronectina 1-receptor 2A activina (FN1-ACVR2A)9,10.
9. DIAGNÓSTICO Y DIAGNÓSTICO DIFERENCIAL
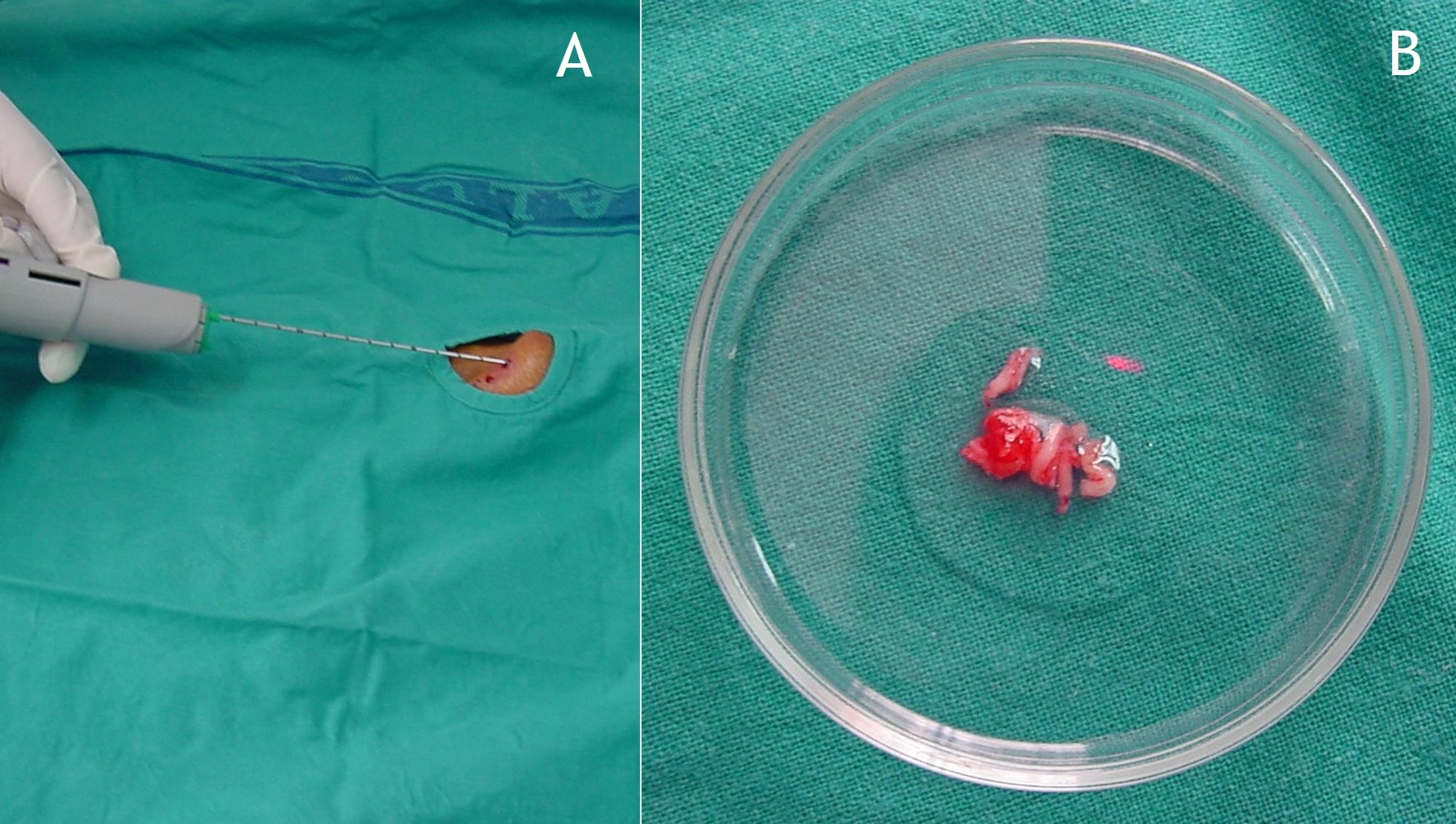
9.1. Diagnóstico: A menudo es tardío por ser frecuentemente asintomática o mostrar sintomatología inespecífica. De hecho, el tiempo medio desde el primer síntoma hasta el diagnóstico se estima en 5 años1. A veces los hallazgos radiográficos son diagnósticos y patognomónicos1,2, aunque puede haber sintomatología sin calcificaciones. De cualquier forma, el estudio radiográfico también es de utilidad para el seguimiento de la enfermedad. En el diagnóstico histológico, la correlación entre estos hallazgos y los de imagen es fundamental para no confundir la entidad con otras malignas3. En algún caso estaría indicada algún tipo de biopsia (Figura 13). Del mismo modo, en casos difíciles la metodología FISH es útil para el diagnóstico9.
Figura 13:
9.2. Diagnóstico diferencial
9.2.1. Clínico:
- Patologías que cursan con sinovitis y/o con cuerpos libres: artropatías de depósito, osteocondritis disecante, artropatías neuropáticas, artritis reumatoide, artrosis, artritis tuberculosa, fracturas osteocondrales, tumores de partes blandas y tumores sinoviales tales como el hemangioma, lipoma arborescente o la sinovitis villonodular pigmentada.
- Condrosarcoma secundario a condromatosis sinovial: Difícil distinción puesto que la invasión ósea, permeación y destrucción articular son eventos tardíos en la evolución de esta entidad.
- Condrosarcoma tenosinovial desdiferenciado con componente de osteosarcoma: Excepcional, muestra un gen de fusión KMT2A-BCOR9.
- Otros sarcomas: Sobre todo se pueden confundir con la CS “tumefactiva”.
- Otras patologías: Tumor de células gigantes tenosinovial, fibroma aponeurótico calcificante, calcinosis tumoral, enfermedades de depósito, cuerpos extraños y artritis inflamatorias5.
9.2.2. De imagen:
- Cuerpos libres: Lesiones osificadas, de morfología redonda a ovalada. Pueden tener cortical madura.
- Las formas extraarticulares se pueden confundir con miositis osificante, calcinosis tumoral, osteosarcomas y condrosarcomas extraesqueléticos y con osteosarcomas parostales4.
- Condrosarcoma secundario a condromatosis sinovial: La distinción es difícil. Los signos patognomónicos, incluyendo la infiltración intramedular y la permeación, están presentes en una minoría de casos12. La erosión cortical periarticular, la extensión extracapsular y los hallazgos de cartílago metaplásico son inespecíficos13. Sí sugieren la malignización la progresión de los síntomas, la recidiva local rápida y la infiltración muscular, del mismo modo que el tamaño tumoral es un indicador fuerte de malignidad12,13.
9.2.3. Histológico:
- Condroma de partes blandas: Este no está en relación directa con la membrana sinovial o tenosinovial. También es distinta la composición de un nódulo solitario de cartílago hialino y la falta de revestimiento sinovial rodeando la lesión. Molecularmente, a diferencia con la condromatosis sinovial, no existen alteraciones en ACVR2A y sí se puede identificar un gen de fusión FN1-FGFR1/2, lo que también es una muestra de que son dos entidades distintas10.
- Condromatosis sinovial secundaria: Se distingue de la forma primaria por ser reactiva, con cuerpos condrales proliferativos que a menudo tienen un nidus central que suele suele ser osificado con crecimiento anular concéntrico alternando capas de cartílago y osificadas, sin atipia citológica. Además, suele haber un menor números de fragmentos condrales de tamaño variable. La anormalidad articular primaria también puede identificarse.
- Condrosarcoma secundario a condromatosis sinovial: Difícil distinción debido a la hipercelularidad, hacinamiento y atipia nuclear1,14. Sugieren la malignidad los cambios mixoides de la matriz, la disposición en forma de lámina o "alineada" de los condrocitos (o la pérdida del agrupamiento normal que se observa en la condromatosis sinovial primaria), la proliferación de células fusiformes de los condrocitos, focos de necrosis e invasión ósea y la permeación medular3. En el 75% de las ocasiones existen reordenamientos FN1-ACVR2A mediante FISH10, como también existen en la condromatosis sinovial, si bien en menor proporción (en torno al 60%). También podría ser de utilidad la expresión reducida o ausente de Bcl2, aunque también es controvertido14. En cualquier caso, es fundamental la correlación clínica y de imágenes para un diagnóstico correcto. En el caso de la malignidad se atenderá a la destrucción cortical con invasión medular ósea y permeación, lo que es mejor identificado con RM.
- Condrosarcoma intraóseo de bajo grado extendido a la articulación: Se distinguirían por los hallazgos de imagen.
10. TRATAMIENTO
10.1. General: Aunque la historia natural de la CS es muy variable y el tratamiento debe adaptarse a cada caso, en general el de elección es quirúrgico y se recomienda que sea precoz para evitar la sintomatología y daños articulares por la enfermedad, sobre todo en presencia de síntomas mecánicos por cuerpos libres intraarticulares. El diagnóstico precoz y el tratamiento correspondiente evitaría daños intra y periarticulares, con la correspondiente sintomatología1. No obstante, la posibilidad de formas autolimitadas justifica el manejo conservador en base a fármacos antiinflamatorios, modificación de la actividad y crioterapia1.
Millgram11 propuso una sinovectomía en el estadio I de la CS; una sinovectomía con resección de los fragmentos condrales en el estadio II; y la resección aislada de los cuerpos libres condrales en el estadio III.
10.2. Cirugía: El tratamiento definitivo y único efectivo de una CS primaria es la resección de los cuerpos libres, con o sin sinovectomía. Este gesto es controvertido y su principal ventaja, en caso de realizarse, es la disminución del riesgo de recidivas. La sinovectomía puede ser realizada por vía artroscópica (Figura 14) o abierta (Figuras 15-19), con menos morbilidad para la primera opción. El abordaje artroscópico suele ser preferido, sobre todo en localizaciones como puede ser la del tobillo, donde un abordaje combinado anterior y posterior sería el procedimiento más efectivo7. El procedimiento también es eficaz y seguro en el codo6. No obstante, también en estos asientos se contempla un abordaje abierto8. El tratamiento artroscópico no estaría tan indicado en casos de CS “tumefactiva” o cuando hay muchos y/o muy grandes cuerpos libres. En estos casos podría preferirse la sinovectomía abierta, al igual que en articulaciones pequeñas (como la esterno-clavicular), cuando está afectada la cara posterior de la rodilla o en las formas extraarticulares1,3. Otro punto controvertido es la efectividad de la sinovectomía parcial comparada con la total, con diferentes grados de riesgo de recidiva, obviamente.
Figura 14:
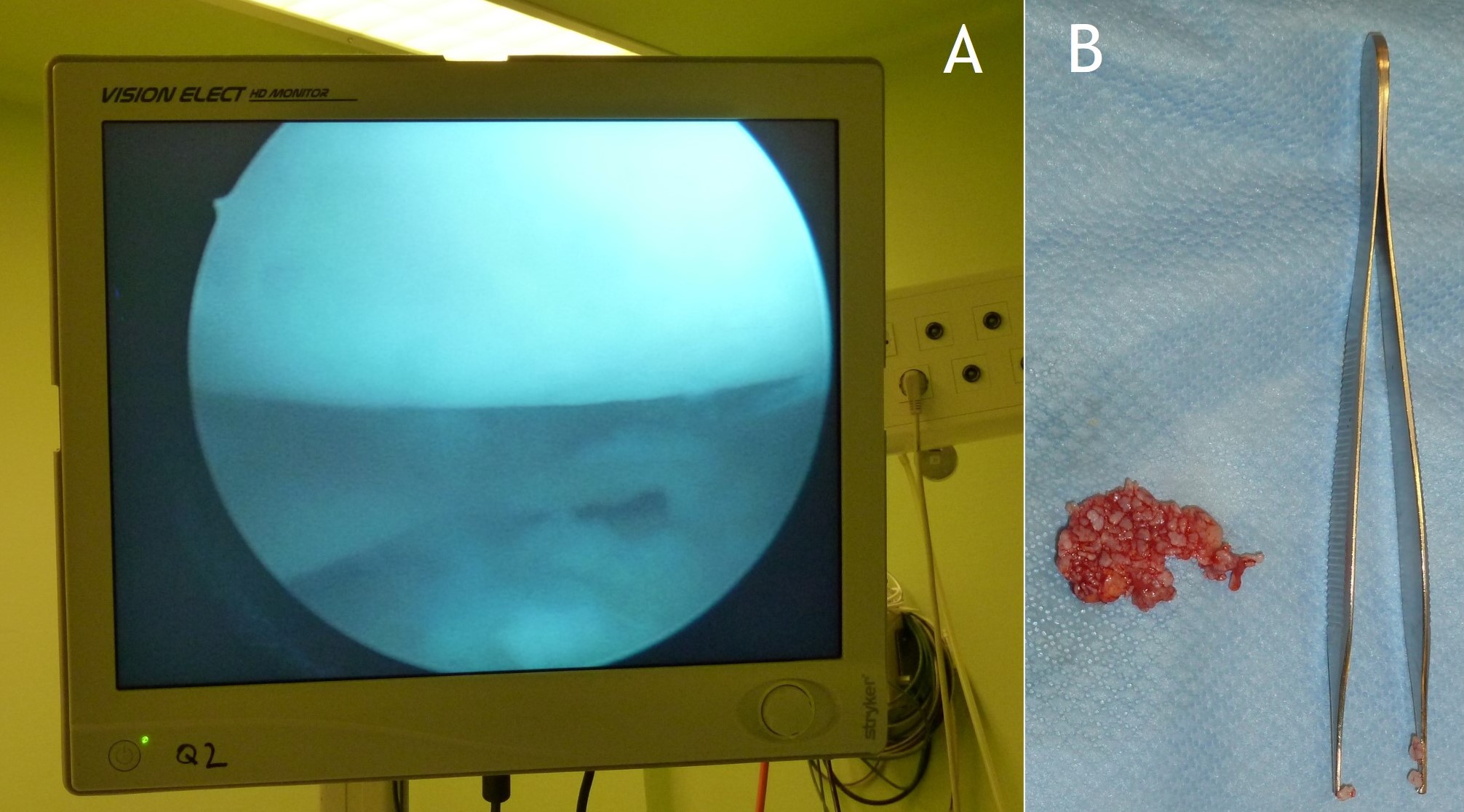
Figura 15:
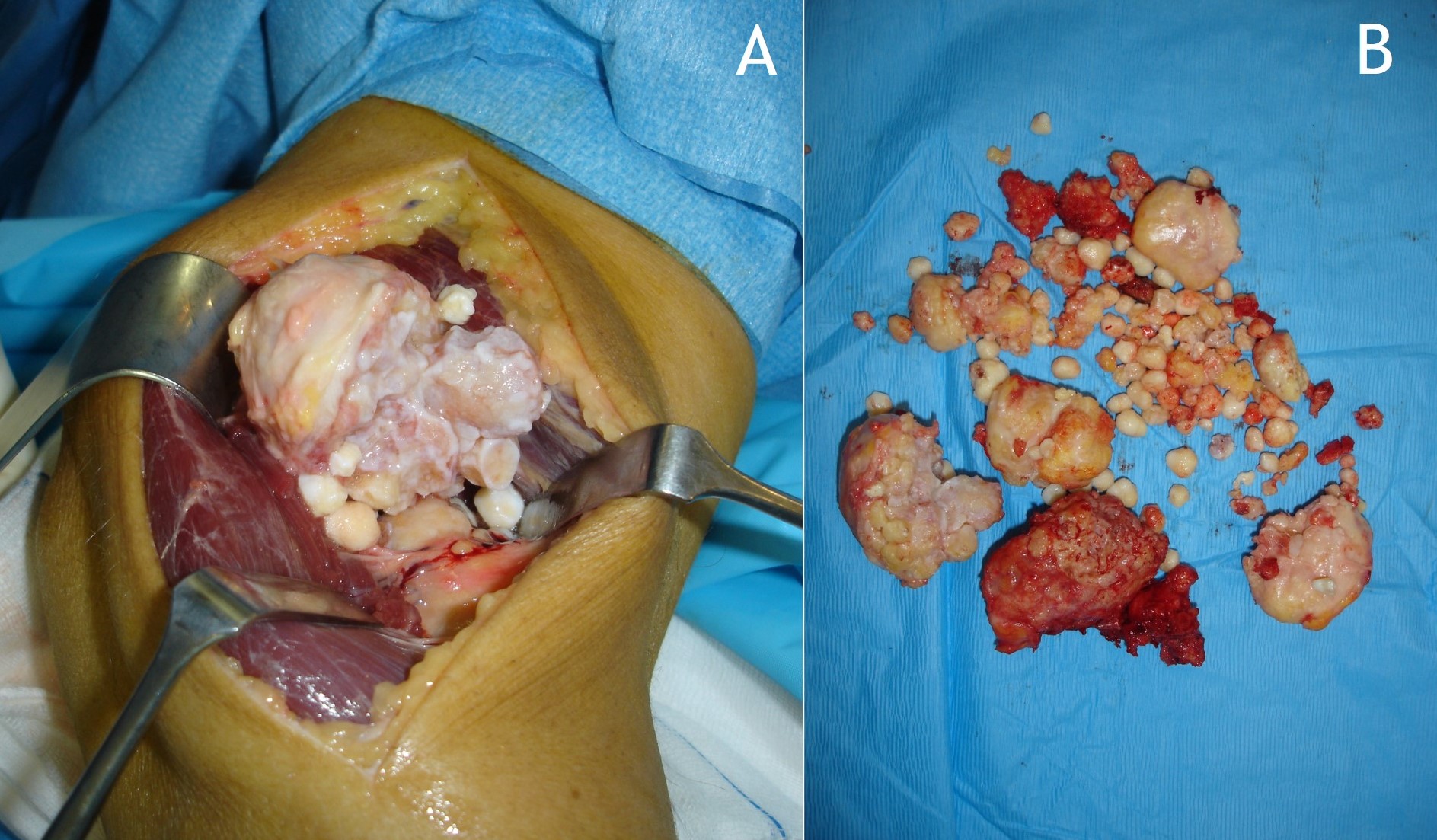
Figura 16:
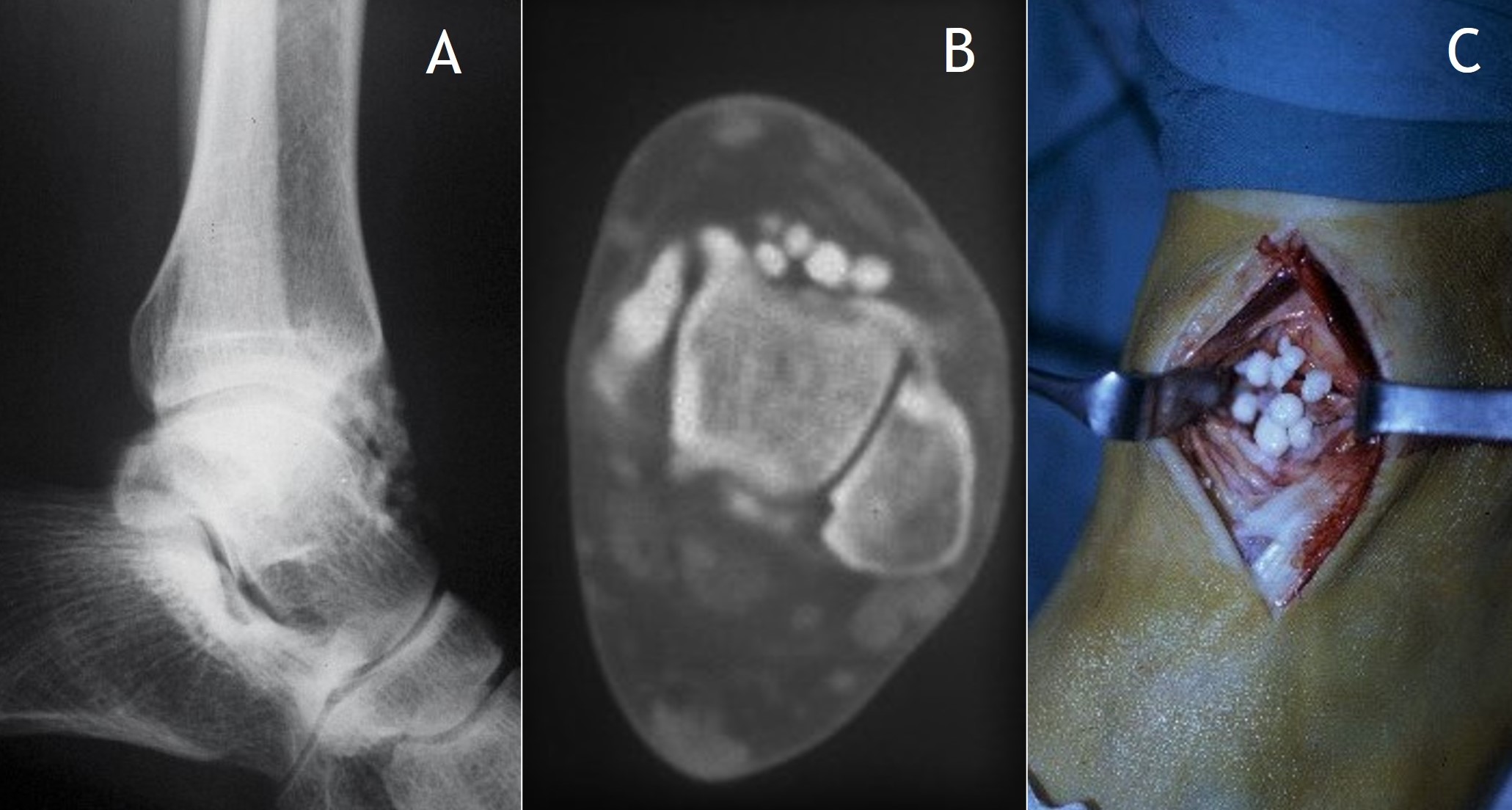
Figura 17:
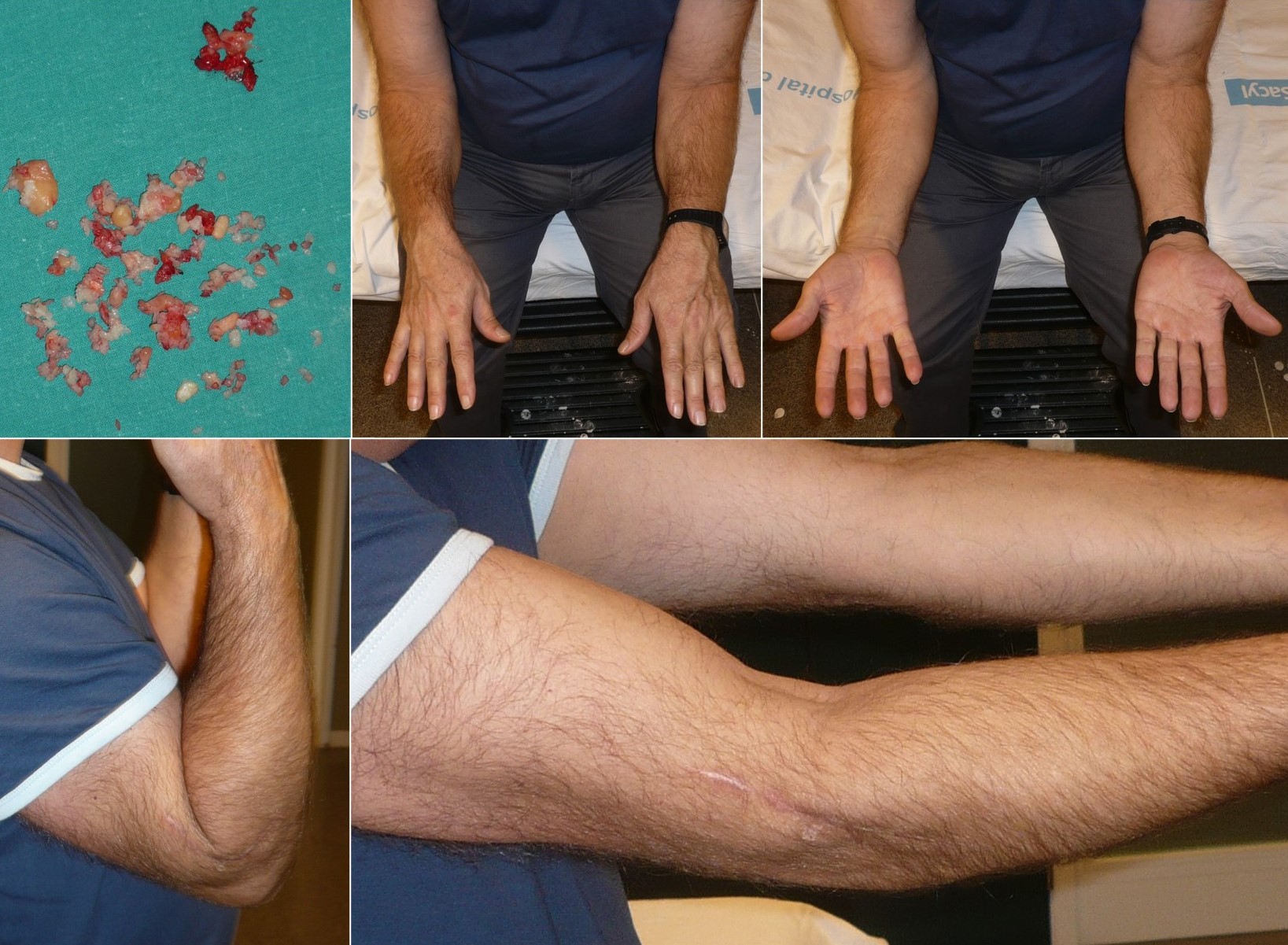
Figura 18:
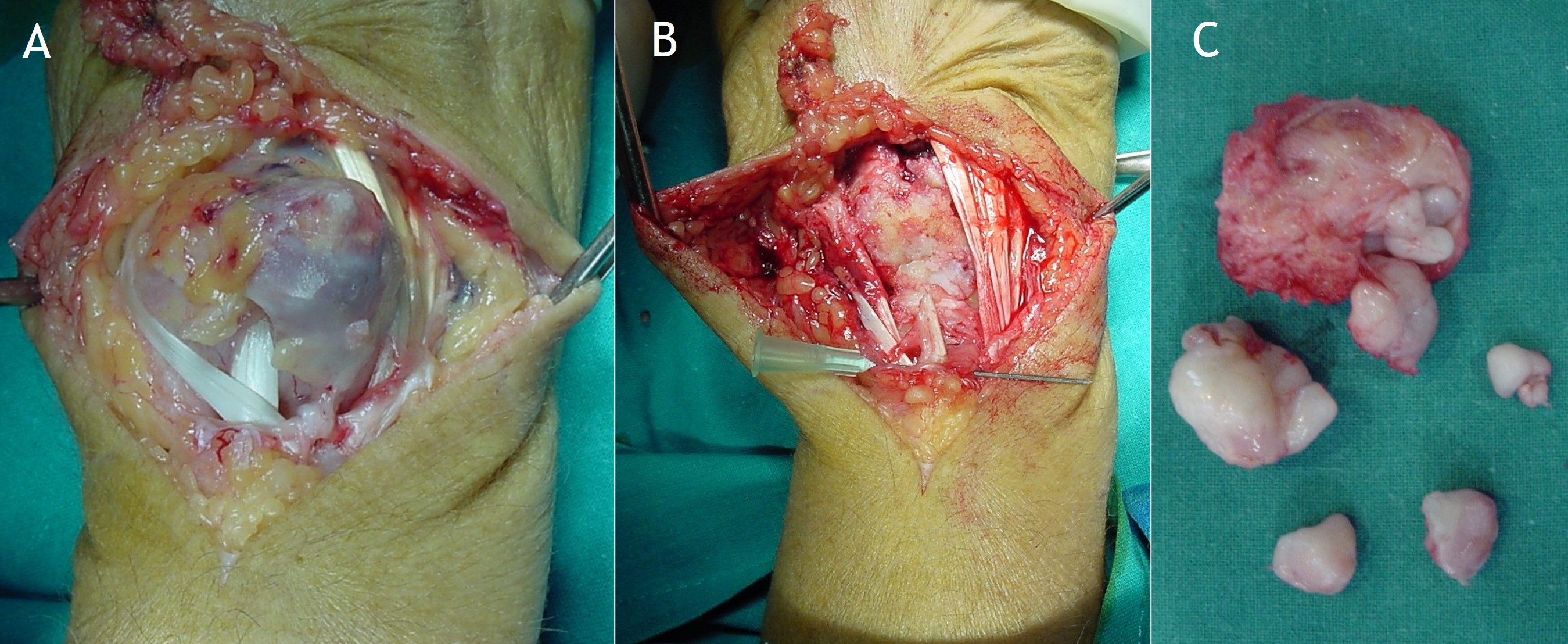
Figura 19:
10.3. Otros métodos: Como ya se ha apuntado, incluirían la observación expectante, AINEs y hasta infiltraciones con corticoides6, sobre todo en casos en estadio I de Millgram.
11. PRONÓSTICO
11.1. Factores pronósticos: Existe la posibilidad de la regresión espontánea con los años, aunque es muy poco frecuente1. El tamaño lesional, el número de lesiones y el grado de cambios no se correlacionan con la malignidad1.
11.2. Recidivas: Dependen de que se haga sinovectomía o no después de la resección de los cuerpos libres articulares. También de si se hace una sinovectomía total o parcial y de la localización de la enfermedad. En cualquier articulación, sin sinovectomía, el riesgo de recidiva se estima en un 3-60%, pareciendo mayor en los casos tenosinoviales9. En la cadera, en el 11-24% de los casos. Cuando se realiza sinovectomía el riesgo oscila entre el 0-8%1. En todos los casos suelen ocurrir en los 5 años que siguen a la cirugía y precisarían de una reintervención quirúrgica. El tratamiento de las recidivas es variado y dependiente del paciente, contemplándose una nueva resección de los nódulos o artroplastias o artrodesis en pacientes con deterioro articular grave5.
11.3. Malignización: Se estima que ocurre en el 1-10% de los casos1,3,12 y, sobre todo, en mujeres de edad avanzada13. Seguramente en menos del 5% de los casos y sobre todo en la cadera, donde supone el 11% de las condromatosis sinoviales13. La mayoría de las veces la malignización se hace a condrosarcoma sinovial de bajo grado13. Suele ocurrir en recidivas de la CS. Por la misma razón es muy raro que una CS no tratada progrese a un condrosarcoma1. El tiempo medio que se calcula que transcurre desde el diagnóstico de la CS hasta la malignización es de 20 años (rango de 2.5 a 38 años)1. Clínicamente no hay diferencias significativas con respecto a la sintomatología de la CS primaria, localizándose habitualmente en rodilla, cadera, tobillo y codo, en orden de frecuencia3. La distinción entre una recidiva y una malignización también es difícil por todos estos motivos, aunque sería sospechoso el aumento rápido del tamaño lesional, el empeoramiento del dolor o una recidiva local dentro de los 12 meses siguientes a la resección de la condromatosis12. Las metástasis pulmonares son un signo claro de malignidad y algunos han calculado en el 56% de los pacientes, con una mortalidad global del 44-67%3.
La mayoría de las malignizaciones son en forma de condrosarcomas de bajo grado, si bien también es posible que sean de alto grado. Una vez confirmada la complicación mediante biopsia, puesto que suele ser un sarcoma intraarticular, estaría indicada una resección extraarticular, seguida de la reconstrucción que procedería en función de la articulación afectada. Otras veces, sin embargo, no hay más alternativa que la amputación12.
12. BIBLIOGRAFÍA
1. Neumann JA, Garrigues GE, Brigman BE, Eward WC. Synovial chondromatosis. JBJS Rev. 2016;4(5):e2.
DOI: https://doi.org/10.2106/JBJS.RVW.O.00054
PUBMED: https://pubmed.ncbi.nlm.nih.gov/27490219/
2. Sacks CA. Synovial chondromatosis. N Engl J Med. 2019;381(14):1364.
DOI: https://doi.org/10.1056/NEJMicm1813672
PUBMED: https://pubmed.ncbi.nlm.nih.gov/31577878/
DOI: https://doi.org/10.1148/rg.275075116
4. Sumida K, Kobasahi N, Nambu A, Tago M, Shibuya I, Kawamoto M. Solitary synovial chondromatosis arising in the glueus maximus bursa: computed tomography and magnetic imaging findings. Acta Radiol Open. 2016;5(3): 2058460115617352.
DOI: https://doi.org/10.1177/2058460115617352
PUBMED: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4780096/
5. Ho YY, Choueka J. Synovial condromatosis of the upper extremity. J Hand Surg. 2013;38A:804-10.
DOI: https://doi.org/10.1016/j.jhsa.2013.01.041
PUBMED: https://pubmed.ncbi.nlm.nih.gov/23474166/
6. Zhu W, Wang W, Mao X, Chen Y. Arthroscopic management of elbow synovial chondromatosis. Medicine. 2018;97(40):e12402.
DOI: https://doi.org/10.1097/MD.0000000000012402
PUBMED: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6200517/
7. Al Farii H, Doyle-Kelly C, Marwan Y, Volesky M, Turcotte R. Arthroscopic management of synovial chondromatosis of the ankle joint. A systematic review of the literature. JBJS Rev. 2020;8(9):e20.00045.
DOI: https://doi.org/10.2106/JBJS.RVW.20.00045
PUBMED: https://pubmed.ncbi.nlm.nih.gov/33151646/
8. Scholl DM, Taddie KL. Asymptomatic synovial chondromatosis of the ankle: An incidental finding. J Foot Ankle Surg. 2010;49:565.e13-565.e17.
DOI: https://doi.org/10.1053/j.jfas.2010.08.002
PUBMED: https://pubmed.ncbi.nlm.nih.gov/20851002/
DOI: https://doi.org/10.1002/gcc.22812
10. Amary F, Perez-Casanova L, Ye H, Cottone L, Strobl A, Cool P, et al. Synovial chondromatosis and soft tissue condroma: extraosseous cartilaginous tumours defined by FN1 gene rearrangement. Mod Pathol. 2019;32(12):1762–71.
DOI: https://doi.org/10.1038/s41379-019-0315-8
PUBMED: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6882679/
11. Milgram JW. Synovial osteochondromatosis: a histopathological study of thirty cases. J Bone Joint Surg Am. 1977;59:792–801.
PUBMED: https://pubmed.ncbi.nlm.nih.gov/908703/
12. Ng VY, Louie P, Punt S, Conrad EU. Malignant transformation of synovial chondromatosis: A systematic review. Open Orthop J. 2017;11:517-24.
DOI: https://doi.org/10.2174/1874325001711010517
PUBMED: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5481616/
13. McCarthy C, Anderson WJ, Vlychou M, Inagaki Y, Whitwell D, Gibbons CLMH, Athanasou NA. Primary synovial chondromatosis: a reassessment of malignant potential in 155 cases. Skeletal Radiol. 2016;45:755-62.
DOI: https://doi.org/10.1007/s00256-016-2353-3
PUBMED: https://pubmed.ncbi.nlm.nih.gov/26919862/
14. Sperling BL, Angel S, Stoneham G, Chow V, McFadden A, Chibbar R, et al. Synovial chondromatosis and chondrosarcoma: a diagnostic dilemma. Sarcoma.2003;7(2):69-73.
DOI: https://doi.org/10.1080/13577140310001607293
PUBMED: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2395520/
13. FIGURAS
Figura 1. Aspecto clínico de condromatosis sinoviales de hombro en mujer de 85 años (A) y del codo en varón de 62 años (B).

Figura 2: Aspecto clínico de condromatosis sinovial extraarticular de tendones extensores de la mano en una mujer de 68 años.

Figura 3: Rx de condromatosis sinovial de la rodilla.

Figura 4: Rx de condromatosis sinovial primaria del codo en dos pacientes (A y B).

Figura 5: Rx de condromatosis sinovial del hombro, con omartrosis secundaria.

Figura 6: Rx AP de la cadera mostrando las calcificaciones de una condromatosis sinovial extraarticular de la bursa trocantérea.

Figura 7: TC de condromatosis sinovial de la figura 4B: proyección coronal (A), sagital (B) y axial a diferentes niveles (C y D).

Figura 8: RM en diferentes cortes y secuencias del caso de las figuras 4B y 7.

Figura 9: Rx (A) y RM en secuencias ponderadas en T1 y T2 en proyecciones coronales (B y C).

Figura 10: Rx (A) y corte axial de RM (B) de la condromatosis sinovial extraarticular de la figura 2.

Figura 11: Gammagrafía ósea de la condromatosis sinovial extraarticular de las figuras 2 y 10.

Figura 12: Aspecto microscópico de un nódulo cartilaginoso con células agrupadas en nidos y adherido a la membrana sinovial. Condromatosis sinovial primaria.

Figura 13: Biopsia cerrada con trucut de la condromatosis sinovial extraarticular de las figuras 2, 10 y 11.

Figura 14: Tratamiento artroscópico de una condromatosis sinovial de la rodilla: resección de cuerpos libres (A) y sinovectomía parcial (B).

Figura 15: Tratamiento quirúrgico de sinovectomía del codo mediante artrotomía (A) y resección de cuerpos libres osteocondrales (B).

Figura 16: Condromatosis sinovial del tobillo: Rx lateral (A), corte axial de TC (B) y resección de cuerpos libres mediante artrotomía por cara anterior del tobillo (C).

Figura 17: Resultado funcional del tratamiento de una condromatosis sinovial del codo mediante resección de los cuerpos libres intraarticulares y sinovectomía parcial al año de la intervención en un varón de 48 años de edad.

Figura 18: Tratamiento quirúrgico de la condromatosis sinovial extraarticular de las figuras 2 y 10,11 y 13. Se observa el aspecto macroscópico de la lesión (A), el lecho de la resección con el sacrificio de uno de los tendones rodeados por la lesión (B) y los fragmentos osteocondrales (C).

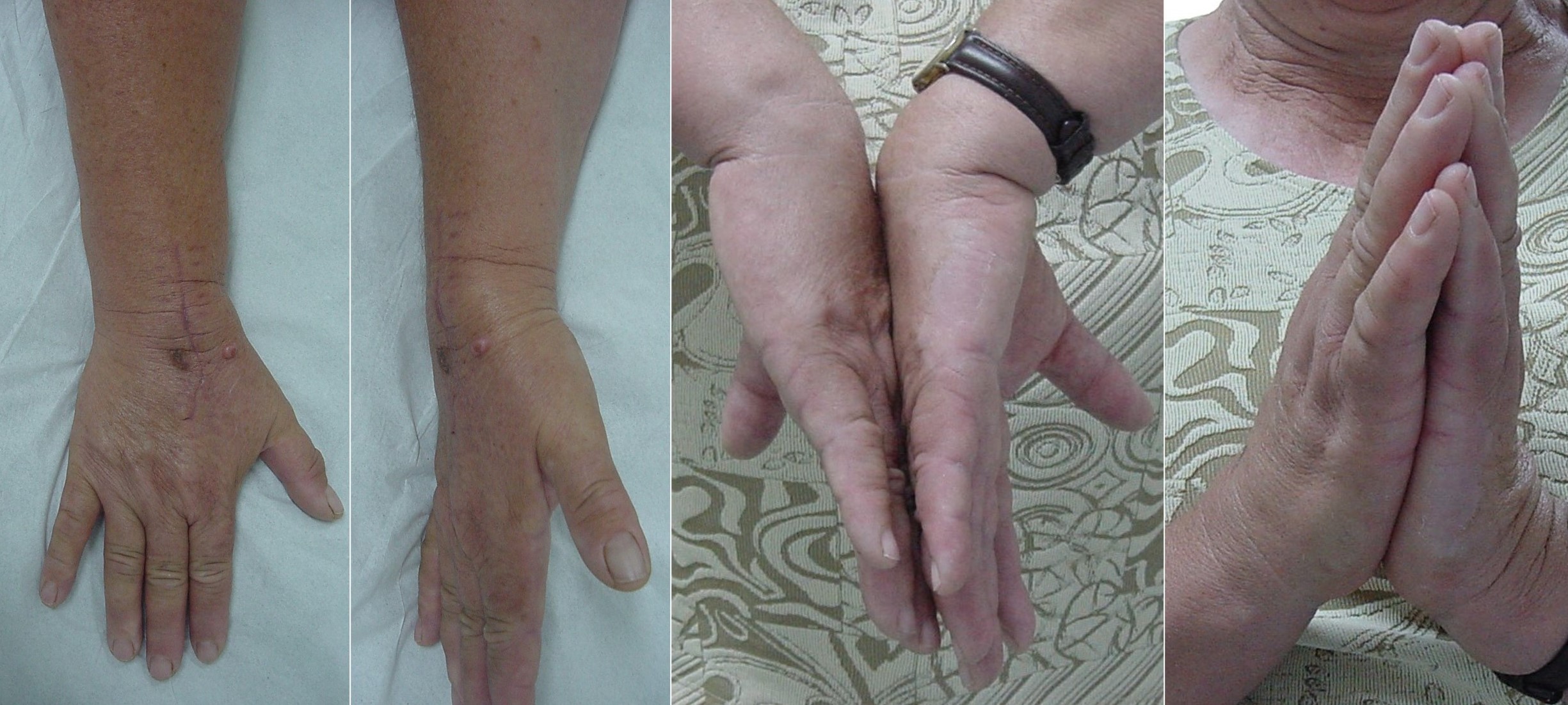
Figura 19: Resultado funcional del tratamiento quirúrgico de la condromatosis sinovial extraarticular de las figuras 2, 10, 11, 13 y 18.
