
Teoría
Autores
Ramos Pascua, Luis Rafaela
Merino Sánchez, Mª Concepciónb
López Martín, José Antonioc
Gascón Costoso, Nievesd
Especialidad
aCirugía Ortopédica y Traumatología
bRadiología
cOncología Médica
dRadioterapia Oncológica
Centro:
a,b,c,dHospital Universitario 12 de Octubre
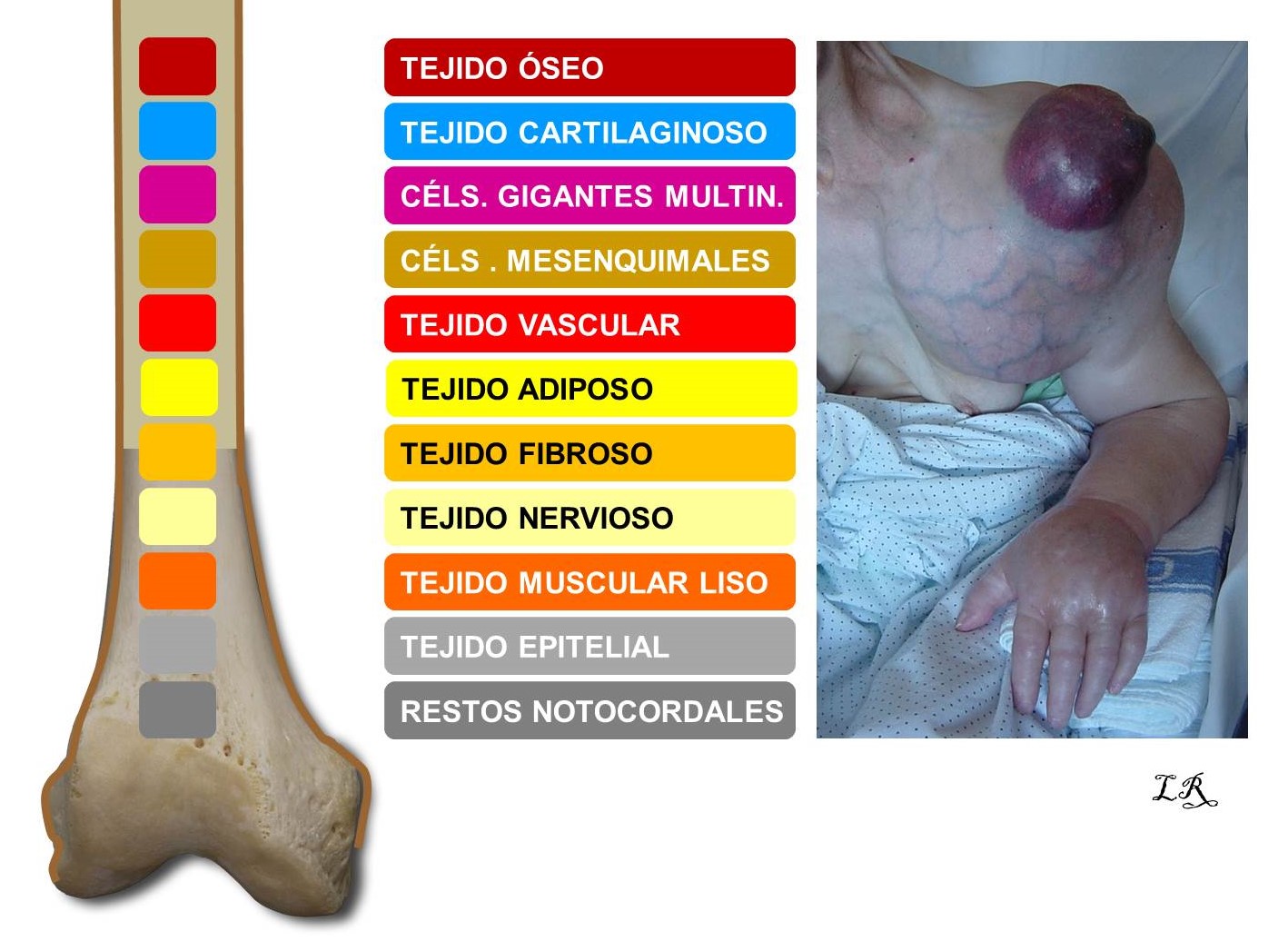
Un tumor óseo es un crecimiento anormal de células de alguno de los muchos tejidos que existen en los huesos (Figura 1), derivados del mesodermo embrionario.
FIGURA 1
2. CLASIFICACIÓN
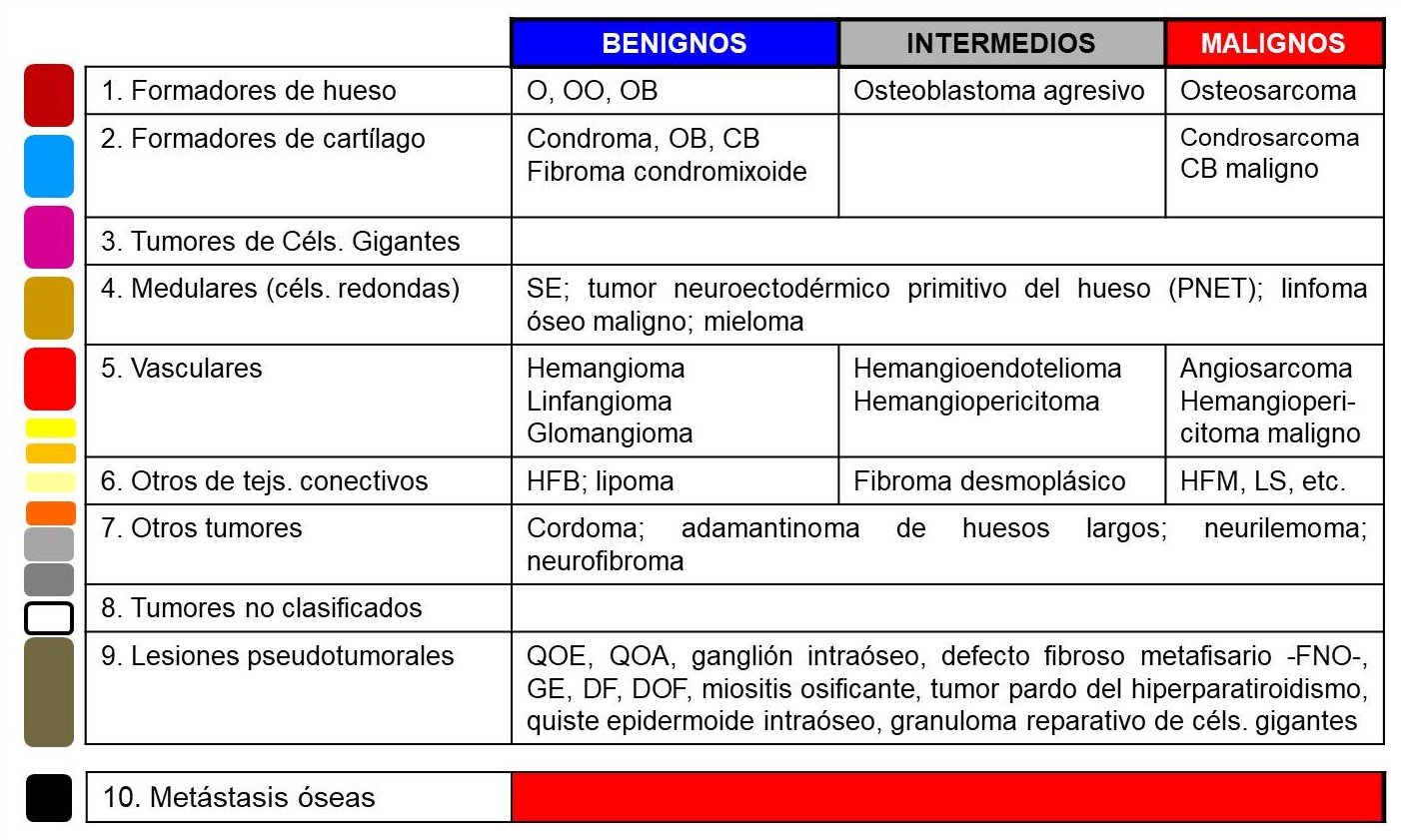
Los tumores óseos se clasifican histológicamente según el tejido del que se originan, que habitualmente reproducen (Tabla 1). En la mayor parte de cada grupo histológico existen formas benignas y malignas, con la particularidad de que algunos
tumores histológicamente benignos pueden metastatizar manteniendo su histología original. Algunos, además, pueden hacerse malignos, con el consiguiente mayor riesgo de extenderse a órganos distantes en forma de metástasis. Las metástasis óseas
y las clásicamente conocidas como lesiones pseudotumorales también son y se estudian como tumores óseos.
TABLA 1:
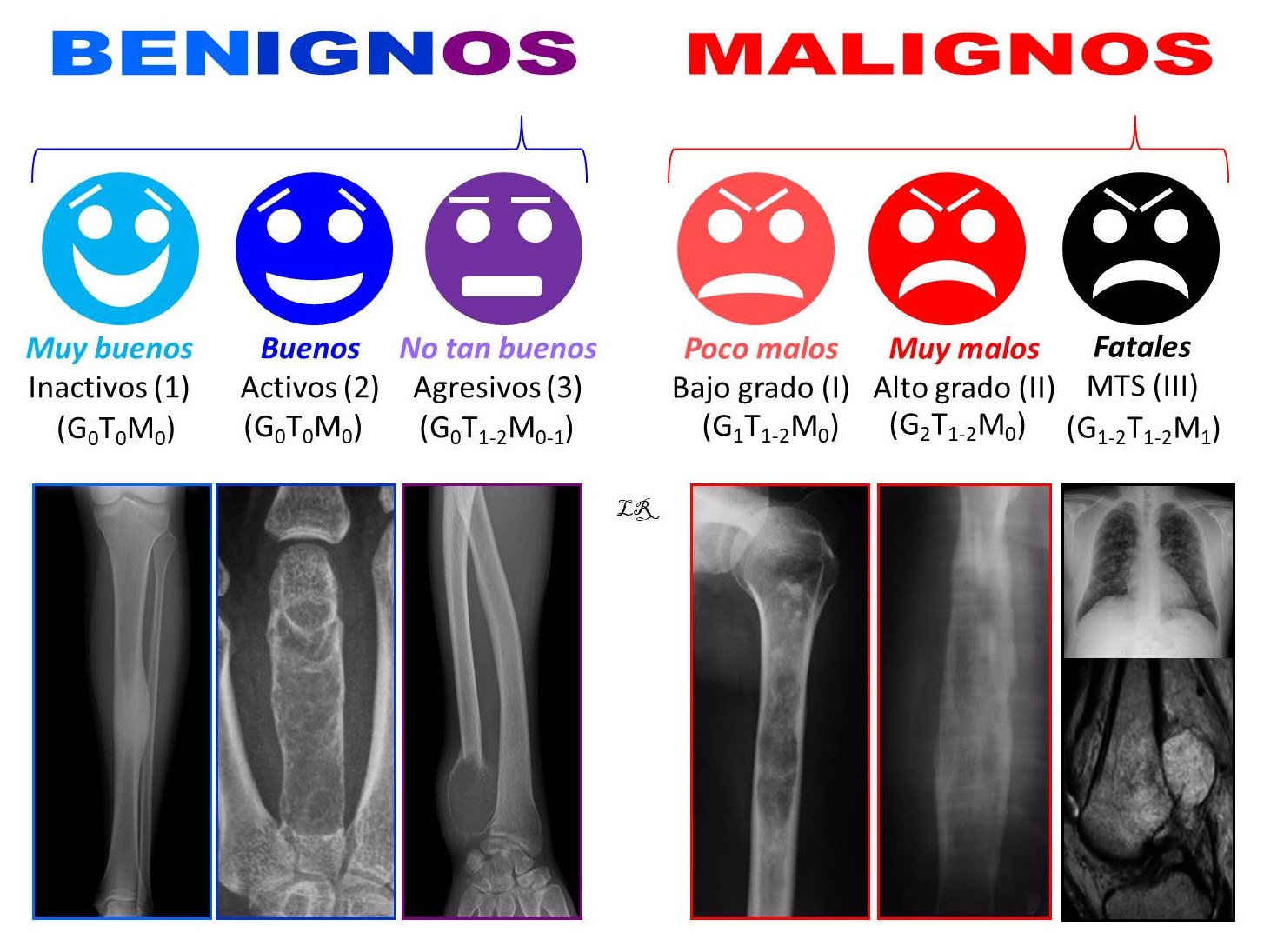
El sistema de estadificación de Enneking distingue, entre los tumores óseos benignos, lesiones inactivas o latentes, activas y agresivas1. Entre los tumores óseos malignos diferencia entre tumores de bajo y alto grado de malignidad, sin y con metástasis, y si su localización es intra (A) o extracompartimental (B). La clasificación no incluye las metástasis óseas ni los tumores hematológicos (Figura 2).
FIGURA 2:
Con respecto a la clasificación de los márgenes de la resección en el ámbito de los sarcomas, el sistema de la MSTS (Musculoskeletal Tumor Society), basado en la clasificación de Enneking, el sistema TNM de la AJCC ( American Joint Committee on Cancer) y la distancia mínima del margen al tumor según el College of American Pathologists tienen algunas imprecisiones y limitaciones. Frente a ellas se ha propuesto un protocolo que tenga en consideración los cambios histopatológicos que acontecen en el tumor por la quimioterapia, cuando sea el caso, y se ha adaptado el sistema TNM, decidiéndose como umbral aceptable de resección quirúrgica de calidad el superior a 2 mm2.
3. DEMOGRAFÍA
3.1. Incidencia: La incidencia de los tumores óseos es muy variable según el tipo al que nos refiramos. Los benignos más frecuentes son los osteocondromas, aunque si incluyéramos a los defectos fibrosos corticales y fibromas no osificantes serían estos. Entre los malignos, los más frecuentes son las metástasis. Le siguen los mielomas, el osteosarcoma, el condrosarcoma y el sarcoma de Ewing, en este orden. El sarcoma de Ewing es el más frecuente en la edad infantil. En números absolutos, se diagnostica aproximadamente un sarcoma óseo y 3-4 mielomas por cada 100.000 habitantes y año, suponiendo el total de estos tumores óseos malignos primitivos menos del 1% de todos los cánceres.
3.2. Sexo: No hay diferencias significativas en la afectación por sexos, aunque puedan existir variaciones particulares en algún tipo.
3.3. Edad: La mayor parte de los tumores óseos benignos se diagnostican en las primeras décadas de la vida. Entre los malignos, la mayoría de las metástasis, los mielomas, los condrosarcomas, los cordomas y los linfomas óseos son propios de pacientes de mayor edad.
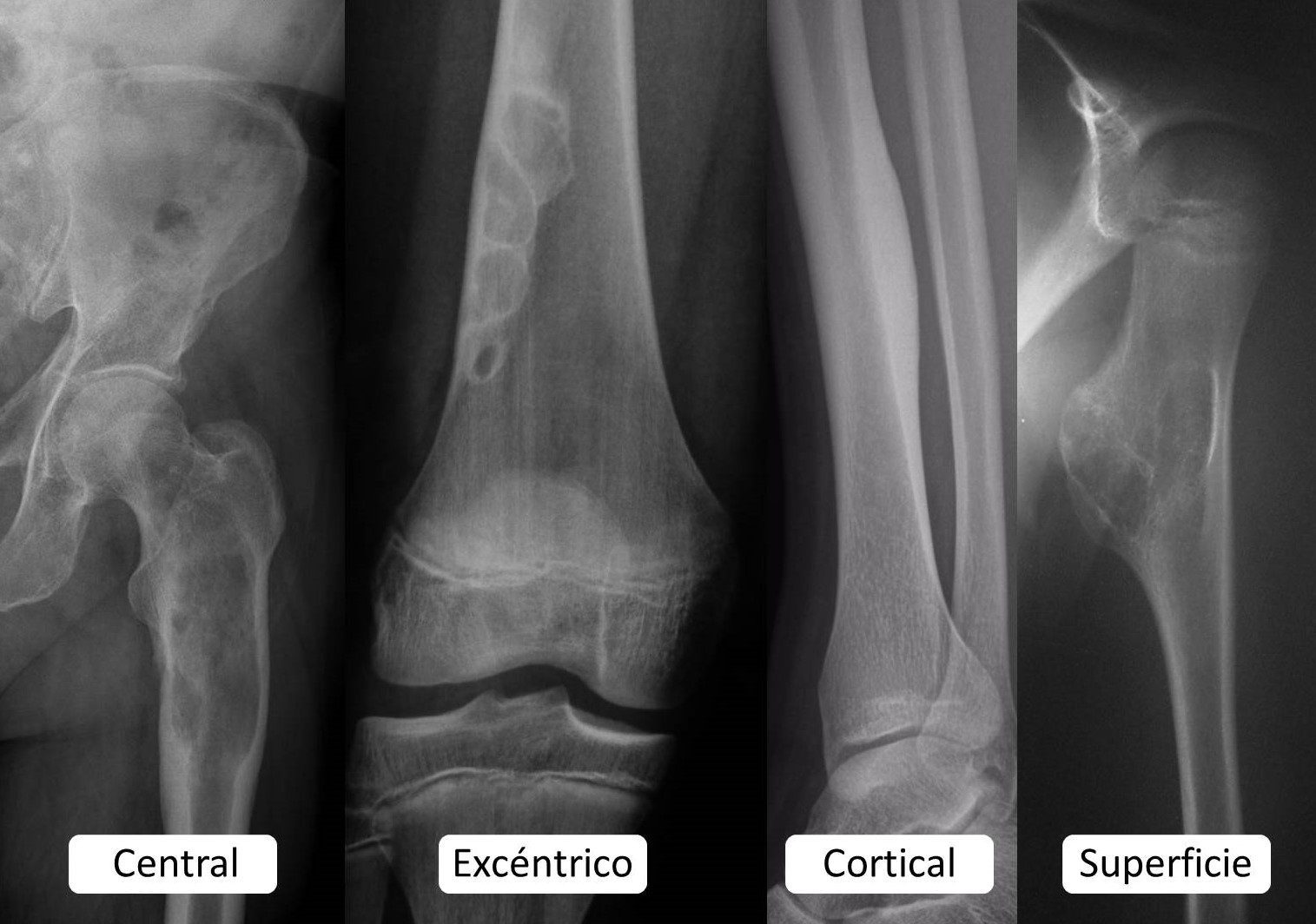
3.4. Localización: El 80% de los tumores óseos primitivos y de las lesiones pseudotumorales asientan en los miembros. Más de la mitad lo hacen en los inferiores y, la mayoría, en el entorno de la rodilla. Cada tipo tumoral suele mostrar preferencias por huesos y segmentos óseos concretos, del mismo modo que pueden originarse en la cavidad medular, en la cortical o en la superficie del hueso (Figura 3). Las metástasis suelen localizarse en el esqueleto axial.
FIGURA 3:
4. ETIOPATOGENIA
En general, se desconoce la causa de un tumor óseo, aunque se han identificado mutaciones en muchos tipos tumorales que estarían implicadas en su patogenia3. Por otra parte, hay tumores óseos malignos secundarios a la degeneración de la enfermedad de Paget ósea, a la radioterapia y a otros agentes externos.
5. PRESENTACIÓN CLÍNICA
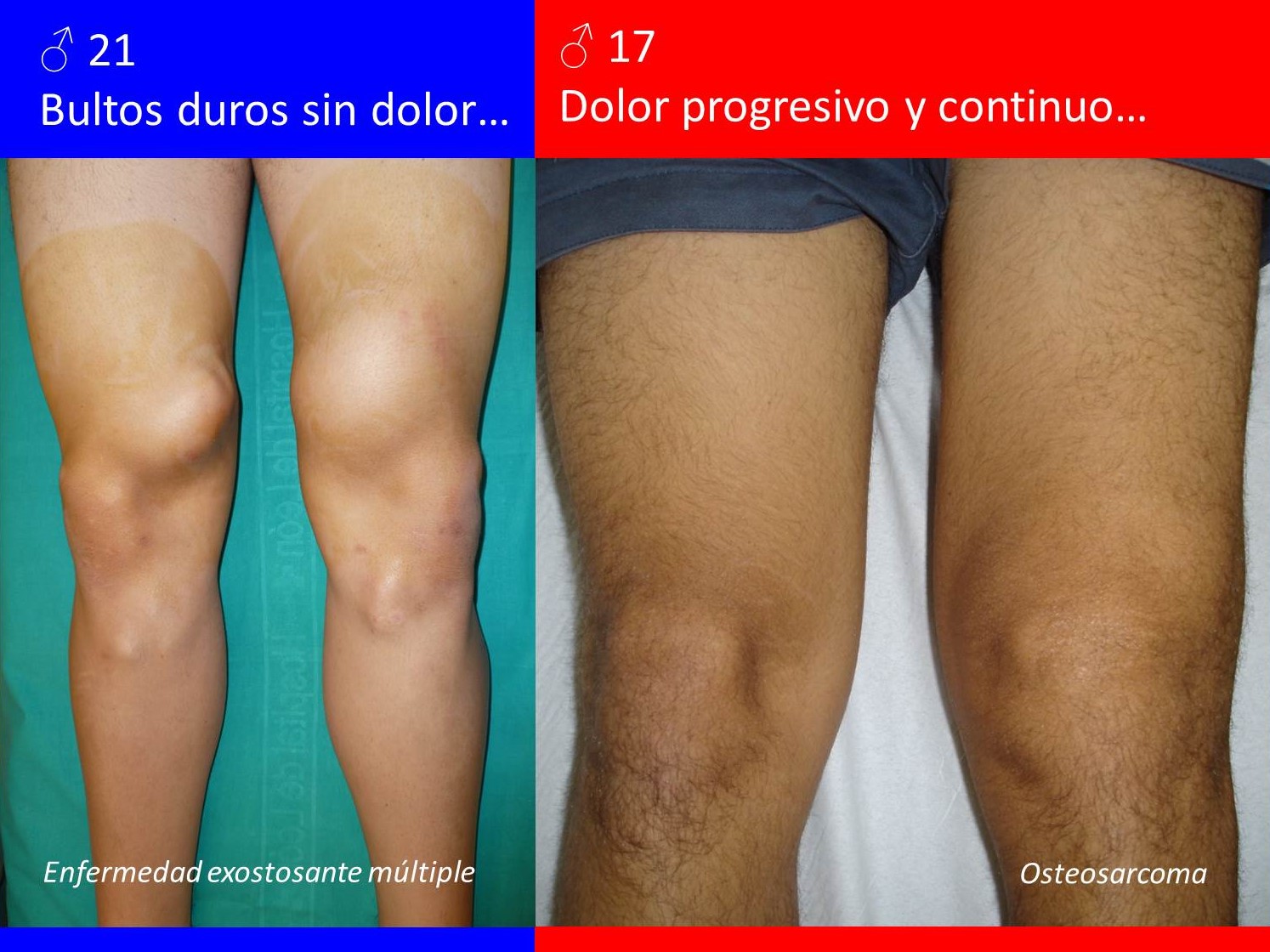
Inespecífica, pudiendo ser asintomáticos. Los que no lo son suelen cursar con dolor y/o tumoración, con más o menos impotencia funcional (Figura 4). Los malignos, dependiendo del tipo y extensión, podrían asociar sintomatología constitucional.
FIGURA 4:
6. PRUEBAS DE LABORATORIO
Son de utilidad en el mieloma múltiple (donde se puede demostrar un incremento de la VSG, el componente monoclonal de la enfermedad y proteinuria de Bence-Jones), en metástasis de neuroblastomas (con incremento de metabolitos de las catecolaminas), en el hiperparatiroidismo y en la búsqueda del cáncer primario en una metástasis ósea a través de diferentes marcadores tumorales. En el sarcoma de Ewing y en el osteosarcoma también pueden estar elevadas las cifras de LDH y fosfatasa alcalina, respectivamente, si bien en los niños suelen estar elevadas de forma fisiológica.
Otras pruebas de laboratorio disponibles en la actualidad son la técnica de la inmunoperoxidasa, técnicas de citometría de flujo, estudios citogenéticos, estudios de marcadores moleculares derivados del tumor primario y de “células tumorales circulantes” (CTC), que son aquellas que se desprenden del tumor y circulan por la sangre4. En la actualidad quedan pocos subtipos de tumores óseos sin caracterizar a nivel genómico, si bien estas alteraciones no siempre permiten distinguir formas benignas de malignas de un tumor específico3,5.
7. PRUEBAS DE IMAGEN
7.1.
Radiología simple: Es la prueba complementaria fundamental para el diagnóstico de sospecha de un tumor óseo, permitiendo diferenciar, a través de la lectura sistemática de la radiografía,
con el recurso añadido de la comparación entre las realizadas en diferentes momentos, entre lesiones agresivas y no agresivas (Figuras 5 y 6
y Tabla 2). En algún caso, incluso maligno, como sería en los osteosarcomas parostales y en los condrosarcomas periféricos secundarios a la degeneración de un osteocondroma, puede ser tan importante para el diagnóstico como la biopsia, si no más.
FIGURA 5:
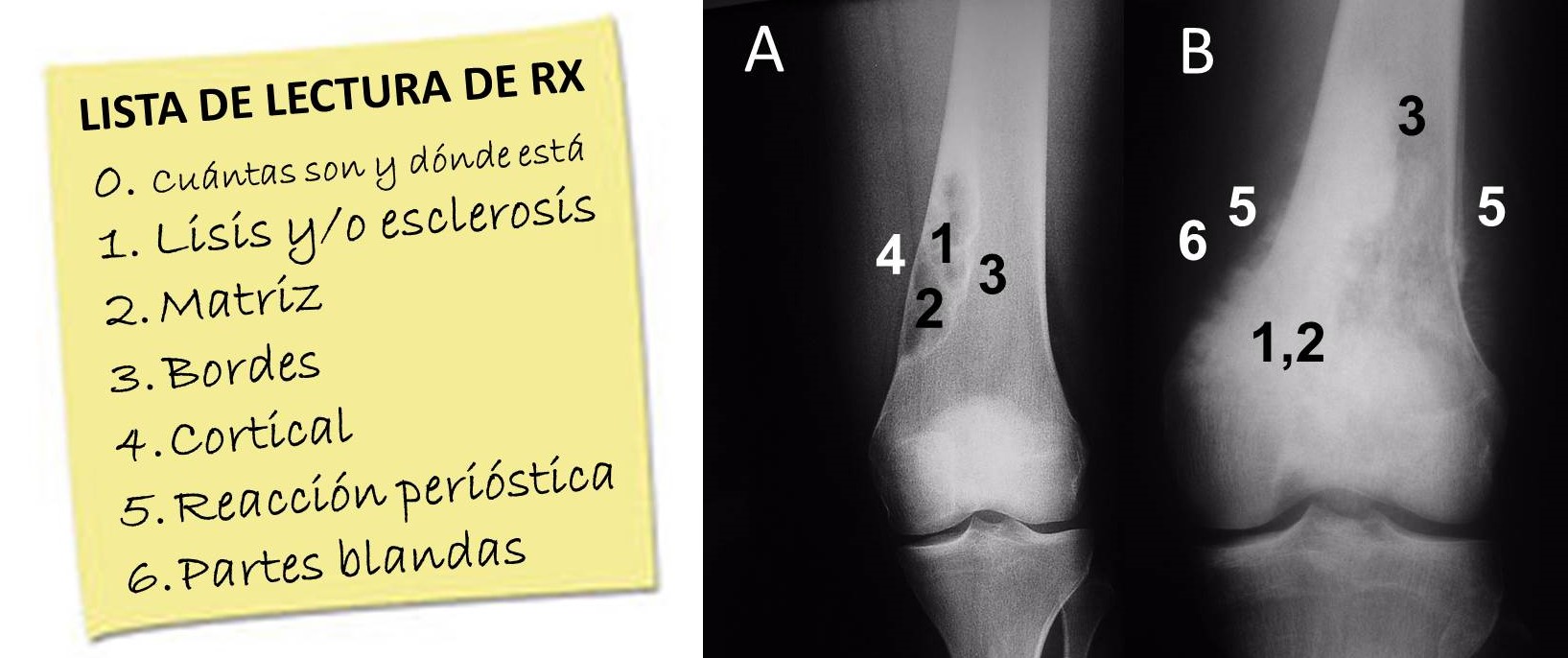
FIGURA 6:
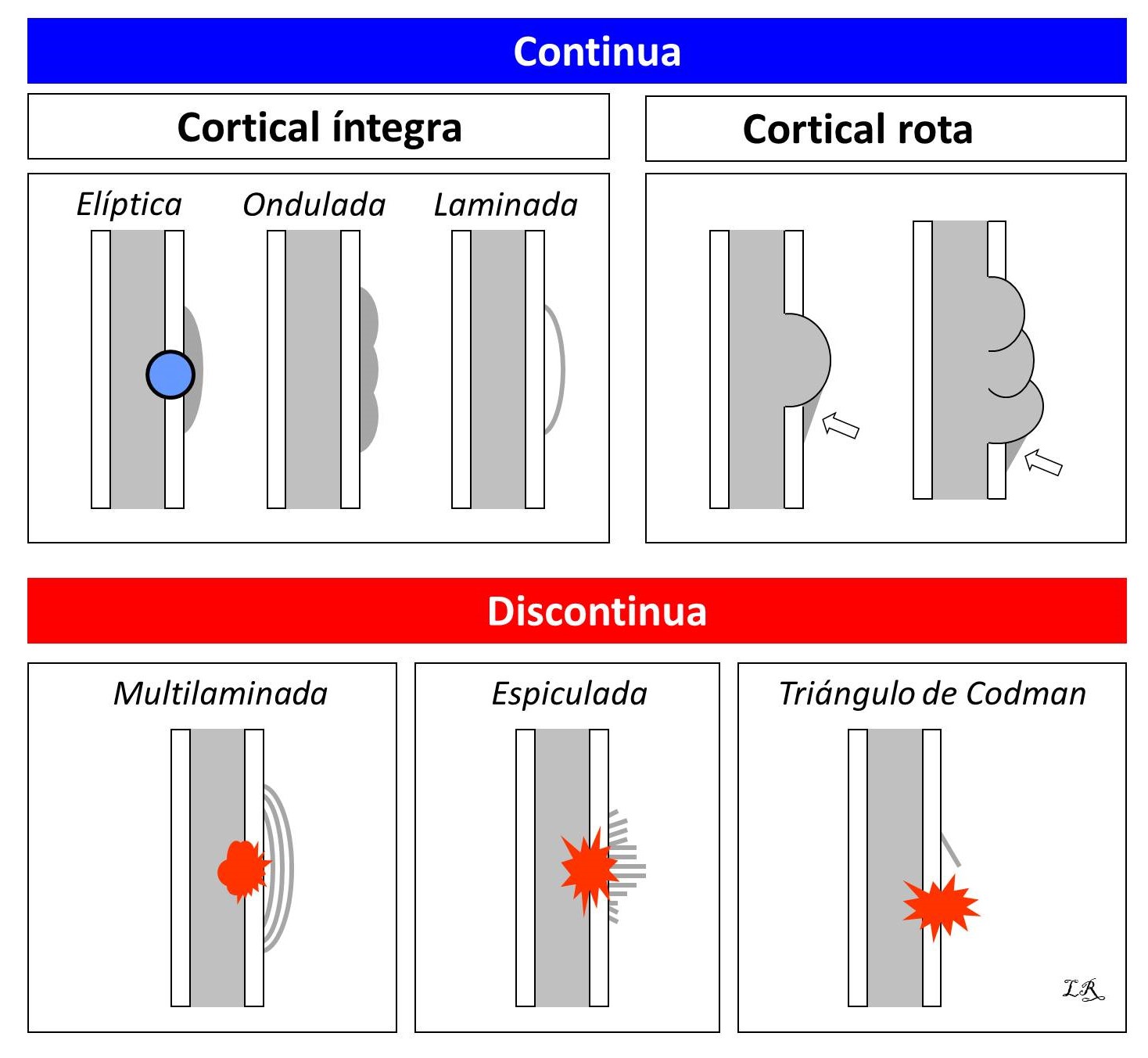
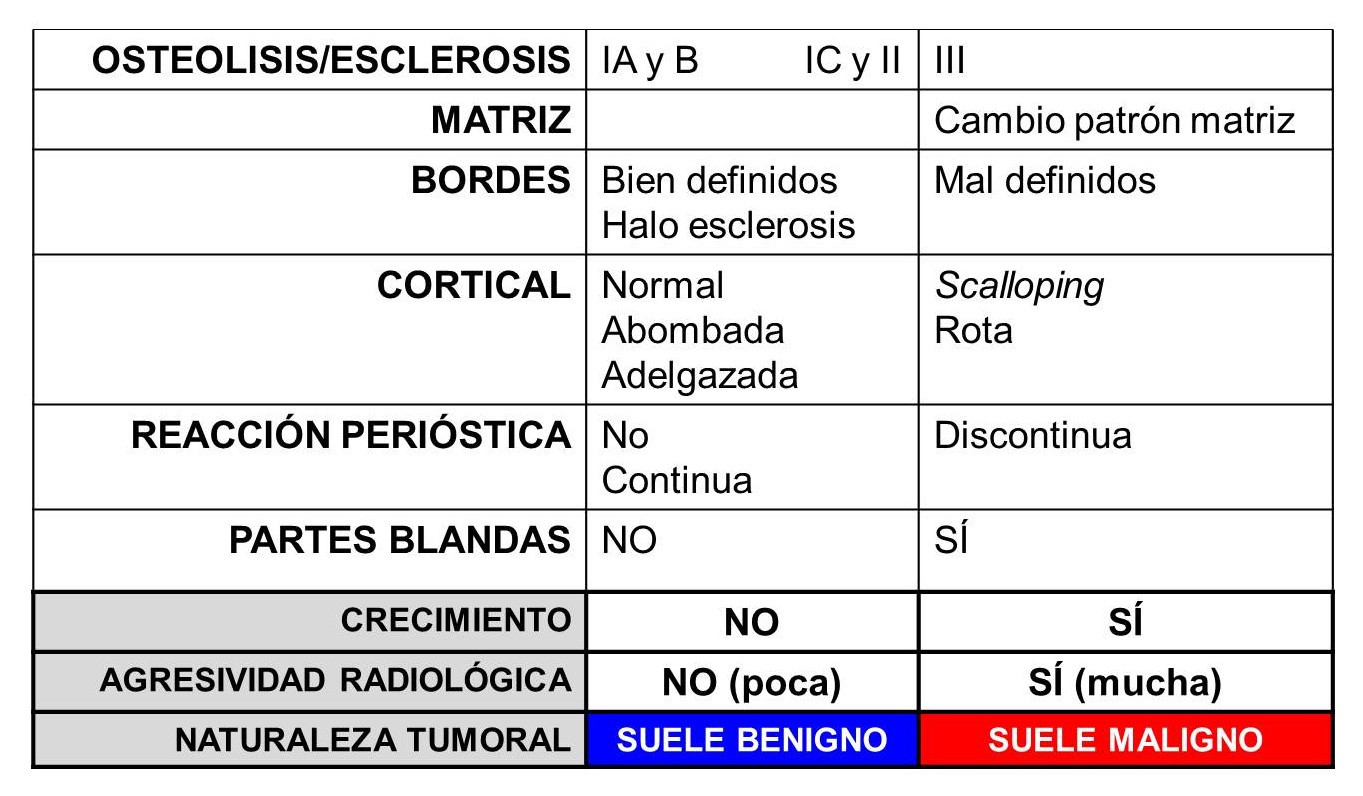
TABLA 2:
7.2. Otras pruebas complementarias de imagen: Cada una con sus ventajas e inconvenientes, a nivel local la TC y la RM aportan información de utilidad diagnóstica y terapéutica. La RM de difusión en la evaluación de la respuesta a la quimioterapia neoadyuvante en los casos en los que está indicada también tiene valor pronóstico6. La angiografía está indicada para realizar embolizaciones tumorales y administrar quimioterapia por vía intraarterial. Para estudiar el sistema circulatorio de cara a la planificación de una intervención quirúrgica podría sustituirse por la angio-TC o la angio-RM. La extensión de la enfermedad se estudia mediante radiografía de tórax, TC tóraco-abdominal, gammagrafía ósea y tomografía por emisión de positrones (PET). En el escenario terapéutico, las imágenes en los sistemas de navegación son de gran utilidad en las planificaciones quirúrgicas7,8.
Particular para cada tipo de tumor óseo.
9. DIAGNÓSTICO Y DIAGNÓSTICO DIFERENCIAL
9.1. Diagnóstico: El diagnóstico de sospecha de un tumor óseo se basa en datos clínicos y de imagen, principalmente radiográficos. La confirmación es siempre patológica a partir de una muestra tisular obtenida mediante biopsia, aunque no todos los casos la precisan. Puesto que no hay pruebas moleculares que sean enteramente sensibles o específicas para un tumor, sigue siendo necesario interpretar los resultados de la patología molecular en el contexto clínico, de imagen e histológico de cada caso3,5.
9.2. Diagnóstico diferencial radiológico: Cada tipo tumoral tiene un diagnóstico diferencial más o menos amplio y fundado que incluye otros tumores y lesiones no tumorales9, como pueden ser infecciosas, traumáticas, metabólicas, degenerativas, etc. La experiencia específica es fundamental para la interpretación10.
9.3. Diagnóstico diferencial anatomo-patológico: Particular para cada tipo tumoral.
10. TRATAMIENTO
El objetivo del tratamiento de un tumor óseo puede ser curativo o, menos veces, paliativo. Los métodos para conseguirlo pueden ser de actuación local o sistémica. Entre los primeros, obviando la observación en muchos casos benignos inactivos, se incluyen la cirugía, la radioterapia y muchos de aplicación tópica en forma de adyuvantes. Los métodos de control general de la enfermedad incluyen la quimioterapia, que también tiene efecto local, la hormonoterapia, el interferon, etc. Algunos pueden aplicarse mediante procedimientos mínimamente invasivos.
En el contexto quirúrgico, las nuevas tecnologías (cirugía navegada por ordenador, impresión 3D, etc) mejoran la precisión de la resección y facilitan la reconstrucción, proporcionando grandes ventajas teóricas en los procedimientos de conservación de los miembros, sobre todo en localizaciones anatómicas complejas como la pelvis o el sacro8; o cuando se deben realizar osteotomías multiplanares o transepifisarias7. En la planificación de la reconstrucción de un defecto óseo con homoinjertos facilita la selección y el tallado del injerto7. Frente a la seguridad y precisión, tienen la limitación de la posibilidad del fallo técnico y de prolongar el tiempo quirúrgico, aparte de que no sirve de guía para la resección en las partes blandas, donde un margen adecuado es igualmente importante2.
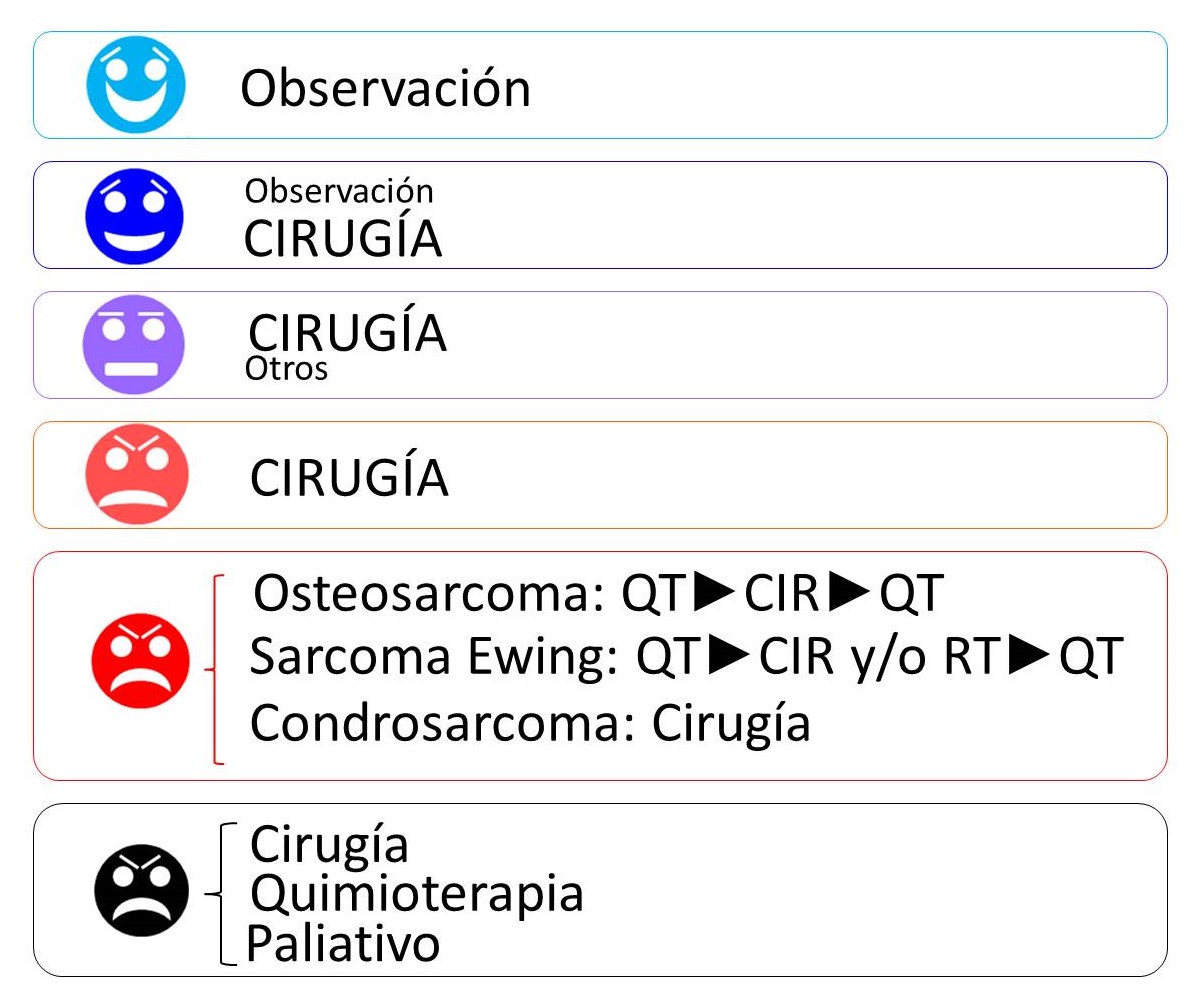
Las indicaciones terapéuticas dependen del tipo tumoral (Figura 7) y de muchas otras circunstancias, entre las que pueden incluirse las preferencias del cirujano y del paciente informado. La mayoría de los tumores óseos benignos estadio 1 y algunas lesiones pseudotumorales se tratan con curetaje simple, cuando no se vigilan. La mayoría de las formas activas y algunas de las agresivas se tratan con curetaje agresivo (con o sin adyuvantes locales) o con resección marginal o amplia. Algunas lesiones agresivas se tratan con resecciones amplias que requieren reconstrucciones complejas. Las lesiones primitivas malignas sólo se controlan localmente con resecciones amplias o radicales. En lesiones de bajo grado la cirugía es el único tratamiento verdaderamente eficaz. En lesiones de alto grado se emplea la quimioterapia adyuvante y, en tumores radiosensibles, ocasionalmente la radioterapia para aumentar las posibilidades de control local y la supervivencia del paciente. El esquema terapéutico suele incluir, en este orden: quimioterapia neoadyuvante, tratamiento local (cirugía y/o radioterapia) y quimioterapia adyuvante11,12. En el tratamiento quirúrgico, los márgenes marginales e intralesionales son inadecuados y requieren reintervenciones y terapias adyuvantes en la mayoría de los casos. Finalmente, las metástasis pulmonares, cuando son pocas y accesibles a la cirugía, se pueden extirpar. El esqueleto inmaduro precisa de consideración particular13.
FIGURA 7:
Los tumores benignos agresivos y los malignos no metastásicos, además de otros que lo puedan precisar, deben tratarse en centros especializados de forma multidisciplinaria, sometiéndose a la oportuna discusión crítica en comités11,12,14. No hacerlo así se ha demostrado menos eficaz y eficiente, además de poder ser motivo de demandas médico-legales15. Un cirujano ortopédico oncológico, por ejemplo, se recomienda que realice al menos 3-4 intervenciones al mes (30-40 cada año) y que participe en grupos y reuniones científicas específicas, además de deber difundir los resultados de su actividad14.
11. PRONÓSTICO
El pronóstico de un tumor óseo se refiere a los resultados oncológicos y funcionales de su tratamiento. Los resultados oncológicos se refieren al riesgo de recidiva del tumor, al desarrollo de metástasis y a la posibilidad de fallecimiento del paciente. Los resultados funcionales se refieren a las complicaciones derivadas del tratamiento y a la funcionalidad final del paciente, que se puede evaluar con diferentes escalas. Por todo ello el seguimiento clínico y mediante imágenes de cada caso es obligado y riguroso durante el tiempo que precise.
12. BIBLIOGRAFÍA
-
Enneking WF, Spanier SS, Goodman MA. A system for the surgical staging of musculoskeletal sarcoma. Clin Orthop Relat Res. 1980;153:106-20.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/7449206 -
Gomez-Brouchet A, Mascard E, Siegfried A, De Pinieux G, Gaspar N, et al. Assessment of resection margins in bone sarcoma treated by neoadjuvant chemotherapy: Literature review and guidelines of the bone group (GROUPOS) of the French sarcoma group and
bone tumor study group (GSF-GETO/RESOS). Orthop Traumatol Surg Res. 2019;105(4):773-80.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/30962172
- DOI: 10.1016/j.otsr.2018.12.015 -
Baumhoer D, Amary F, Flanagan AM. An update of molecular pathology of bone tumors. Lessons learned from investigating samples by next generation sequencing. Genes Chromosomes Cancer. 2019;58:88-99.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/30582658
- DOI: 10.1002/gcc.22699 -
Li M, Lu Y, Long Z, Li M, Kong J, Chen G, et al. Prognostic and clinicopathological significance of circulating tumor cells in osteosarcoma. J Bone Oncol. 2019 Apr 3;16:100236.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/31024791
- DOI: 10.1016/j.jbo.2019.100236 - Jones KB. Musculoskeletal oncology. En: Flynn JM, editor. Orthopaedic knowledge update, 10th edn. Rosemont: American Academy of Orthopaedic Surgeons; 2011. p. 192-212.
-
Kubo T, Furuta T, Johan MP, Adachi N, Ochi M. Percent slope analysis of dynamic magnetic resonance imaging for assessment of chemotherapy response of osteosarcoma or Ewing sarcoma: systematic review and meta-analysis. Skeletal Radiol. 2016;45:1235-42.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/27229874
- DOI: 10.1007/s00256-016-2410-y -
Aponte-Tinao L, Ritacco LE, Ayerza MA, Muscolo L, Albergo JI, Farfalli GL. Does intraoperative navigation assistance improve bone tumor resection and allograft reconstruction results? Clin Orthop Relat Res. 2015;473:796-804.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/24711134
- DOI: 10.1007/s11999-014-3604-z -
Nandra R, Matharu G, Stevenson J, Parry M, Grimer R, Jeys L. Long-term outcomes after an initial experience of computer-navigated resection of primary pelvic and sacral bone tumours. Soft-tissue margins must be adequate to reduce local recurrences. Bone
Joint J. 2019;101-B:484-90.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/30929483
- DOI: 10.1302/0301-620X.101B4.BJJ-2018-0981.R1 -
Gould CF, Ly JQ, Lattin GE Jr, Beall DP, Sutcliffe JB 3rd. Bone tumor mimics: avoiding misdiagnosis. Curr Probl Diagn Radiol. 2007;36(3):124-41.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/17484955
- DOI: 10.1067/j.cpradiol.2007.01.001 -
Rozenberg A, Kenneally BE, Abraham JA, Strogus K, Roedl JB, Morrison WB, et al. Second opinions in orthopedic oncology imaging: can fellowship training reduce clinically significant discrepancies? Skeletal Radiol. 2019;48:143-7.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/30003278
- DOI: 10.1007/s00256-018-3024-3 -
Casali PG, Bielack S, Abecassis N, Aro HT, Bauer S, Biagini R, et al. Bone sarcomas: ESMO-PaedCan-EURCAN clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2018;29(Suppl. 4):iv79-iv95.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/30285218
- DOI: 10.1093/annonc/mdy310 -
Redondo A, Bagué S, Bernabeu D, Ortiz-Cruz E, Valverde C, Alvarez R, et al. Malignant bone tumors (other than Ewing´s): clinical practice guidelines for diagnosis, treatment and follow-up by Spanish Group for Reseach on Sarcomas (GEIS). Cancer Chemother
Pharmacol. 2017;80:1113-31.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/29038849
- DOI: 10.1007/s00280-017-3436-0 - San-Julian M, editor. Cañadell´s pediatric bone sarcomas. Epipysiolysis before excision. 2nd edition. Pamplona: Springer; 2016.
-
Andritsch E, Beishon M, Bielack S, Bonvalot S, Casali P, Crul M, et al. ECCO essential requirements for quality cancer care: soft tissue sarcoma in adults and bone sarcoma. A critical review. Crit Rev Oncol Hematol. 2017;110:94-105.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/28109409
- DOI: 10.1016/j.critrevonc.2016.12.002 -
Morris CD, Bal BS, D´Elis EM, Benevenia J. Medical and legal considerations in managing patients with musculoskeletal tumors. Instr Course Lect. 2014;63:421-30.
- PUBMED: https://www.ncbi.nlm.nih.gov/pubmed/24720327
13. FIGURAS
13.1. Tabla 1: Clasificación histológica de los tumores óseos.

13.2. Tabla 2: Correlación aproximada entre agresividad radiográfica y comportamiento biológico de un tumor óseo.

13.3. Figura 1: Representación gráfica de los diferentes tejidos del hueso y ejemplo de un osteosarcoma secundario (derecha).

13.4. Figura 2: Clasificación biológica de los tumores óseos.

13.5. Figura 3: Ejemplos de tumores óseos de diferente localización en el hueso.

13.6. Figura 4: Ejemplos de la sintomatología de un tumor óseo benigno (izquierda) y maligno (derecha).

13.7. Figura 5: Protocolo de lectura de la radiografía de un tumor óseo.

13.8. Figura 6: Representación gráfica de los diferentes tipos de reacción perióstica, en azul las no agresivas y en rojo las agresivas.

13.9. Figura 7: Indicaciones generales de tratamiento de los tumores óseos según su naturaleza.
